-
“化学是一门中心学科,与社会、生活有密切的关系”。下列叙述中正确的是
A.液化石油气的主要成分是甲烷
B.不锈钢餐具和目前流通的硬币都属于合金
C.医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡
D.制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料
难度: 中等查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是
A、金刚石属于金属单质 B、制造过程中元素种类没有改变
C、CCl4是一种化合物 D、这个反应是置换反应
难度: 中等查看答案及解析
-
下列实验装置设计正确的是
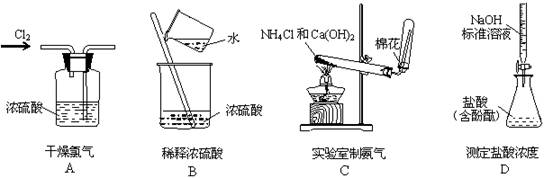
难度: 中等查看答案及解析
-
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
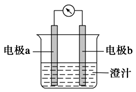
A.原电池是将化学能转化成电能的装置
B.原电池由电极、电解质溶液和导线等组成
C.图中a极为铝条、b极为锌片时,导线中会产生电流
D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片
难度: 中等查看答案及解析
-
下列叙述正确的是
A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
B.第三周期非金属元素含氧酸的酸性从左到右依次增强
C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO—3
D.从C(石墨)=C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4…
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4-…
Cl2、Mn2+…
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
难度: 中等查看答案及解析
-
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH—)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
难度: 困难查看答案及解析