-
下列说法中,正确的是( )
A.分子内脱去一个小分子的反应一定是消去反应
B.可用浓溴水除去苯中混有的苯酚
C.胶体是一种较稳定的分散系,可用渗析法从胶体中分离出离子或小分子
D.向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中含有的卤元素
难度: 简单查看答案及解析
-
下列各元素中,一定属于主族元素的是( )
A.X元素能形成+7价的含氧酸及其盐
B.Y元素原子最外层电子数为2
C.Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同
D.R元素的最高价氧化物是酸性氧化物
难度: 简单查看答案及解析
-
在自然界中的矿物中,CuSO4可将FeS2氧化,生成Cu2S、SO42-和Fe2+。下列表示该反应的离子方程式中,正确的是( )
A.14Cu2++5S22-+12H2O=7Cu2S+3SO42-+24H+
B.14Cu2++5FeS2+28OH-=7Cu2S+3SO42-+5Fe2++14H2O
C.14Cu2+ +5FeS2+24OH-=7Cu2S+3SO42-+5Fe2++12H2O
D.14Cu2++5FeS2+12H2O=7Cu2S+3SO42-+5Fe2++24H+
难度: 简单查看答案及解析
-
下列叙述中,不正确的是( )
①熔点:金刚石>晶体硅>单质硫
②气态氢化物稳定性:H2O>HF>H2S
③同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤ⅥA、ⅦA族元素的阴离子与同周期稀有气体元素的原子具有相同的核外电子排布
A.①②③ B.②③④ C.②④⑤ D.①③⑤
难度: 简单查看答案及解析
-
以Pt为电极,电解含有金属离子
、
各
的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示。对离子氧化能力的强弱判断正确的是(选项中
为氢离子)( )

A.
B.
C.
D.条件不足,无法确定
难度: 简单查看答案及解析
-
常温下,对下列各溶液的叙述不正确的是( )
A.
溶液中:
B.在
的
溶液中,
C.
的盐酸与
的
溶液等体积混合后,溶液中一定有
D.向
氨水中加入少量
固体,溶液中
增大
难度: 简单查看答案及解析
-
新鲜水果、蔬菜、乳制品中富含的维生素C 具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下
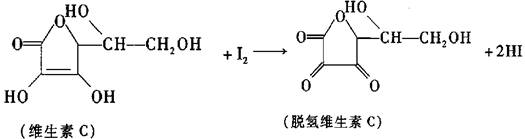
下列说法正确的是( )
A.上述反应为取代反应
B.维生素C在酸性条件下水解得到2种产物
C.维生素C不可溶于水,可溶于有机溶剂
D.维生素C的分子式为C6H8O6
难度: 简单查看答案及解析
-
向100 g FeCl3溶液中放入一小块钠,待反应完全后,过滤,得到仍有棕黄色的溶液91.8g,则投入钠的质量为( )
A.18.4g B.13.8g C.8.2g D.9.2g
难度: 简单查看答案及解析