-
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.原电池反应均是自发的氧化还原反应
B.氢氧燃料电池工作时氢气在正极被氧化
C.氢氧燃料电池是将热能转变为电能的装置
D.铅蓄电池在放电过程中,负极质量减小,正极质量增加
难度: 中等查看答案及解析
-
氢气是人类最理想的能源。已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9kJ,今有如下三个热化学方程式:
(1)H2(g)+
O2(g) = H2O(g) ΔH1=a kJ·mol-1
(2)H2O(l) = H2(g)+
O2(g) ΔH2=b kJ·mol-1
(3)2H2(g)+O2(g) = 2H2O(l) ΔH3=c kJ·mol-1
下列关于它们的表述正确的是
A.2b=c B.b=285.8
C.a=-b D.氢气的燃烧热为a kJ·mol-1
难度: 中等查看答案及解析
-
某酸溶液中c(H+)=0.1mol·L-1,则该酸溶液的物质的量浓度
A.一定等于0.1mol·L-1 B.一定大于0.1mol·L-1
C.一定小于0.1mol·L-1 D.无法确定
难度: 中等查看答案及解析
-
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
N2(g)+CO2(g) △H=-373.4kJ·mol-1
在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
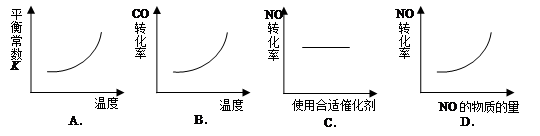
难度: 中等查看答案及解析
-
关于浓度均为0.1mol/L的三种溶液:①NH3·H2O、②HCl、③NH4Cl,下列说法正确的是
A.水电离出的c(H+):②>③
B.①、②和③等体积混合后的溶液:pH=7
C.①和②等体积混合后的溶液: c(H+)=c(OH)+ c(NH3·H2O)
D.①和③等体积混合后的溶液: c(Cl-)>c(NH4+)>c(OH)>c(H+)
难度: 中等查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是
A.取干燥洁净的酸式滴定管即装入标准盐酸
B.用蒸馏水冼净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C.往盛有20.00mLNaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D.用蒸馏水冼净锥形瓶后,再用NaOH液润洗,然后装入一定体积的NaOH溶液
难度: 中等查看答案及解析
-
根据下列热化学方程式
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g) +
O2(g) = H2O(l) △H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A.△H=+244.1kJ/mol B.△H=-488.3kJ/mol
C.△H=-996.6kJ/mol D.△H=+996.6kJ/mol
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.碳酸氢钠水【解析】
HCO3- + H2OH3O+ + CO32-
B.醋酸铵溶于水:CH3COONH4 + H2O
CH3COOH + NH3·H2O
C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-
CaCO3(s) + SO42-
D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.某反应的生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
B.化学反应过程中,发生物质变化的同时不一定发生能量变化
C.SO2能溶于水,所得溶液能导电,所以SO2是电解质
D.计算某反应的反应热可用生成物的键能总和减去反应物的键能总和
难度: 中等查看答案及解析
-
银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,该电池反应的化学方程式为:Zn+Ag2O+H2O
Zn(OH)2+2Ag,下列判断正确的是
A.电池放电时,正极区溶液pH减小
B.电池放电完后,需补充注入水
C.负极电极反应式:2Ag+2OH--2e-=Ag2O+H2O
D.正极电极反应式:Ag2O+H2O+2e-=2Ag+2OH-
难度: 中等查看答案及解析
-
下图中(部分未画出),两电极上发生的电极反应分别为:
a极:2Ag++2e-=2Ag b极:Fe-2e-=Fe2+
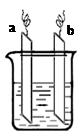
下列说法不正确的是
A.该装置可能是原电池
B.装置中电解质溶液一定含有Ag+
C.该装置在使用时,溶液中的阴离子向a极移动
D.装置中发生的反应方程式是:Fe +2Ag+ = Fe2+ + 2Ag
难度: 中等查看答案及解析
-
某探究小组利用丙酮的溴代反应(CH3COCH3 + Br2 → CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率υ(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号
初始浓度c/mol·L-1
溴颜色消失
所需时间t/s
CH3COCH3
HC1
Br2
①
②
③
④
0.80
1.60
0.80
0.80
0.20
0.20
0.40
0.20
0.0010
0.0010
0.0010
0.0020
290
145
145
580
分析实验数据所得出的结论不正确的是
A.增大c(CH3COCH3),υ(Br2)增大 B.实验②和③的υ(Br2)相等
C.增大c(HCl),υ(Br2)增大 D.增大c(Br2),υ(Br2)增大
难度: 中等查看答案及解析
-
已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol

下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.右图可表示①的反应过程和能量关系
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
难度: 中等查看答案及解析
-
某容积固定的密闭容器中发生可逆反应:A(g)+2B(g)
C(g)+D(g),能说明反应已达到平衡状态的事实是
A.容器内A、B、C、D四者共存 B.VA(正)=2VB(逆)
C.容器内压强不随时间的变化而变化 D.VA(正)=VC(逆)
难度: 中等查看答案及解析
-
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
A.加入10mL 0.08mol·L-1的NaOH溶液 B.加水稀释成100mL
C.加入10mL 0.01mol·L-1的盐酸溶液 D.加入10mL 的水进行稀释
难度: 中等查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A.t2时加入了催化剂(其它条件不变)
B.t3时降低了温度(其它条件不变)
C.t5时增大了压强 (缩小容器体积,其它条件不变)
D.平衡状态时,t6时刻Z的百分含量最低
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
A.NH4+、Fe2+、NO3-、SO42- B.Ba2+ 、Na+、Cl-、NO3-
C.Na+、Cl-、SO42-、HCO3- D.K+、Na+、AlO2-、Cl-
难度: 中等查看答案及解析
-
下列浓度关系正确的是
A.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
B.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+)
C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)
Ba2+(aq)+SO(aq) Ksp=c(Ba2+)·c(SO ),沉淀溶解平衡曲线如图所示。 下列说法正确的是
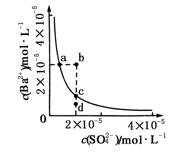
A.b点时c(Ba2+)·c(SO )小于Ksp
B.a点对应的Ksp等于c点对应的Ksp
C.加水稀释可以使溶液由b点变到c点
D.加入适量的Na2SO4可以使溶液由a点变到c点
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c
、c
、c
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、 0.08 mol·L-1,则下列判断正确的是
A.c
∶c
= 1∶3 B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等 D.C1的取值范围为0<C1<0.14 mol·L-1
难度: 中等查看答案及解析