-
化学与生产、生活密切相关,下列有关说法正确的是 ( )
A. 医院里的血液透析利用了胶体的性质
B. PM2.5中含有铅、铬、钒、砷等对人体有害的金属元素
C. 工业冶炼铝常用焦炭还原氧化铝
D. 煤经过气化和液化的物理变化可变为清洁燃料
难度: 中等查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A. 该溶液中,H+、NH
、SO
、Br-可以大量共存
B. 该溶液中,Ag+、K+、NO
、CH3CHO可以大量共存
C. 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D. 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
难度: 中等查看答案及解析
-
下图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子。下列对该过程的相关描述正确的是( )

A.有一种物质过量 B.发生的是分解反应
C.发生的是置换反应 D.生成了两种产物
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列叙述正确的是 ( )
A. 标准状况下2.24 L HF,分子数为0.1 NA
B. 将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA
C. 常温常压下16 g O2和O3混合气体中,氧原子数为NA
D. 7.8 g Na2O2与足量水反应,转移电子数为0.2NA
难度: 中等查看答案及解析
-
下列物质间能直接转化的元素是( )

A.氯 B.硫 C.铝 D.铁
难度: 中等查看答案及解析
-
一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
A. 过量的氢气与氮气 B. 过量的浓盐酸与二氧化锰
C. 过量的浓硫酸与铜 D. 过量的锌与18mol/L硫酸
难度: 中等查看答案及解析
-
下列有关物质的性质或用途的说法中正确的是 ( )
①氯气具有漂白性,可以直接使有色布条褪色
②二氧化硫具有较强的还原性,不能用浓硫酸干燥
③SiO2是酸性氧化物,能与氢氟酸反应
④Al(OH)3是两性氢氧化物,能溶于强酸或强碱
A. ①②③ B. ②③④ C. ③④ D. ①②④
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂
B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂
C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水
D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A. 肯定不含I- B. 可能含SO42-
C. 肯定含有SO32- D. 肯定含有NH4+
难度: 中等查看答案及解析
-
下列有关实验装置的说法中,正确的是

A. 用图①装置,制取干燥纯净的NH3
B. 用图②装置,实验室制备Fe(OH)2
C. 用图③所示实验,可比较氯、碳、硅三种元素的非金属性强弱
D. 用图④装置测量Cu与浓硝酸反应产生气体的体积
难度: 中等查看答案及解析
-
将13.6g带铁锈的铁片溶解于25mL、14mol/L的热的浓硫酸中,气体只有SO2且体积为1.12L (标准状况)。将溶液稀释至100mL,所得溶液遇KSCN溶液时无血红色出现。下列结论正确的是( )
A. 反应中:转移电子3.01×1022个 B. 反应后:剩余硫酸0.30 mol
C. 原混合物:n (Fe2O3):n(Fe)=1:2 D. 所得溶液:c(FeSO4)=1.7mol/L
难度: 极难查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能一步实现的是 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列说法正确的是
A. 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等
B. 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50%
C. 金属钠着火时,立即用泡沫灭火器灭火
D. 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸
难度: 中等查看答案及解析
-
氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O=HOF+HF.该反应中水的作用与下列反应中水的作用相同的是
A.钠与水反应制氢气
B.过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸
D.氟单质与水反应制氧气
难度: 简单查看答案及解析
-
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B. V1:V2=1:5
C. M点时生成的CO2为0.05mol
D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
难度: 简单查看答案及解析
-
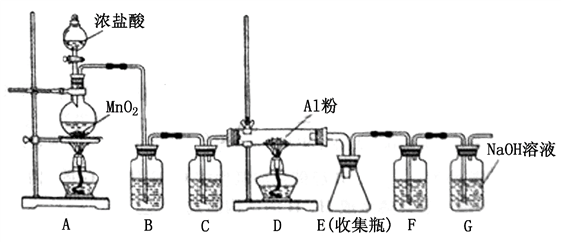
A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是( )

A. 已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
B. 反应②的离子方程式为
C. 新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D. 若反应①在常温下进行,则1mol A在反应中能转移1 mol电子
难度: 中等查看答案及解析