-
据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A. 20Ne和22Ne互为同位素
B. 20Ne和22Ne互为同分异构体
C. 20Ne和22Ne的质量数相同
D. 20Ne和22Ne的中子数相同
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.乙烯的结构简式:CH2CH2
B.NH3的电子式:
C.过氧化氢的电子式:
D.乙酸的球棍模型:

难度: 中等查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
A. CO2 B. NaCl C. Na2O2 D. CH4
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是 ( )
A. V(A)=0.15 mol·L-1·s-1 B. V(B)=0.50mol·L-1·s-1
C. V (C)=0.32 mol·L-1·s-1 D. V(D)=5.40 mol·L-1·min-1
难度: 简单查看答案及解析
-
可逆反应:
在固定容积的密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成
的同时生成
(2)单位时间内生成
的同时生成
(3)用
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
A.(1)(4) B.(2)(3) C.(1)(3)(4) D.(1)(2)(3)(4)
难度: 中等查看答案及解析
-
某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施能加快反应速率的是 ( )
①给试管加热 ②加入铁粉 ③加入冰块 ④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸
A. ①②⑤ B. ①② C. ③④ D. ③④⑤
难度: 简单查看答案及解析
-
下列关于反应速率和反应平衡的说法中,错误的是
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.增大反应物浓度,提高反应物的温度都能增大反应速率
难度: 中等查看答案及解析
-
有关基本营养物质说法正确的是
A.淀粉和纤维素互为同分异构体
B.油脂没有固定的熔沸点
C.葡萄糖、果糖、蔗糖都能发生水解反应
D.糖类、油脂、蛋白质都是高分子化合物
难度: 中等查看答案及解析
-
由乙烯推测丙烯的结构或性质,正确的是( )
A. 分子中三个碳原子在同一直线上 B. 分子中所有原子都在同一平面上
C. 与HCl加成只生成一种产物 D. 由丙烯之间的相互加成可得聚丙烯
难度: 中等查看答案及解析
-
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
序号
35 mL试剂
固体
混合前温度/℃
混合后温度/℃
①
水
2.5 g NaHCO3
20.0
18.5
②
水
3.2 g Na2CO3
20.0
24.3
③
盐酸
2.5 g NaHCO3
20.0
16.2
④
盐酸
3.2 g Na2CO3
20.0
25.1
由此得出的结论正确的是( )。
A. Na2CO3溶液与盐酸的反应是吸热反应
B. NaHCO3溶液与盐酸的反应是放热反应
C. 20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D. 20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
难度: 中等查看答案及解析
-
有三种不同的基团,分别为﹣X、﹣Y、﹣Z,若同时分别取代苯环上的三个氢原子,能生成的同分异构体数目是( )
A.10种 B.8种 C.6种 D.4种
难度: 困难查看答案及解析
-
如图是常见四种有机物的比例模型示意图。下列说法正确的是( )
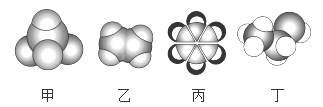
A. 甲能使酸性KMnO4溶液褪色
B. 乙可与溴水发生取代反应使溴水褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的化学键
D. 丁在稀硫酸作用下可与乙酸发生取代反应
难度: 简单查看答案及解析
-
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A. n+8 B. n+16 C. n+18 D. n+32
难度: 中等查看答案及解析
-
下列各实验装置图及其作用正确的是 ( )


A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是
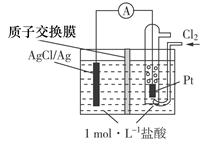
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
D. 若用NaCl溶液代替盐酸,则电池总反应随之改变
难度: 中等查看答案及解析
-
某有机物分子式为C4H8,据此推侧其结构和性质不可能的是( )
A.它与乙烯可能是同系物
B.一氯代物可能只有一种
C.分子结构中甲基的数目可能是0、1、2
D.等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
难度: 中等查看答案及解析