-
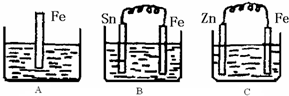
下列叙述中,甲金属一定比乙金属活泼性强的是( )
A.甲原子电子层数比乙原子的电子层数多
B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能难度: 中等查看答案及解析
-
下列说法正确的是( )
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行难度: 中等查看答案及解析
-
下列说法正确的是( )
A.F是最活泼非金属,Li是最活泼金属
B.NaOH易溶于水,Ca(OH)2微溶,所以NaOH碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第ⅡA族难度: 中等查看答案及解析
-
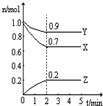
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸难度: 中等查看答案及解析
-
下列结论错误的是( )
①微粒半径:K+>Al3+>S2->C1-
②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
A.只有①
B.①③
C.②④⑤⑥⑦
D.①③⑤难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A12O3,将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,改用氢离子浓度相同的稀硫酸
C.Zn与稀硫酸反应时,适当提高溶液的温度
D.Na与水反应时增大水的用量难度: 中等查看答案及解析
-
下列关于F、Cl、Br、I性质的比较,不正确的是( )
A.它们的原子核外电子层数随核电核数的增加而增多
B.被其它卤素单质从其卤化物中置换出来的可能性随核电核数的增加而增大
C.它们的氢化物的稳定性随核电核数的增加而增强
D.单质的颜色随核电核数的增加而加深难度: 中等查看答案及解析
-
下列说法正确是( )
A.由H原子形成1molH-H键要吸收热量
B.N2性质非常稳定,是因为N2分子中含有氮氮叁键,要破坏氮氮叁键需吸收更多的能量
C.在稀溶液中,酸与碱发生中和反应生成H2O时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应难度: 中等查看答案及解析
-
能源可划分为一级能源和二级能源.自然界中以现成形式提供的能源称为一级能源;需依靠其它能源的能量转换得到的间接能源称为二级能源.下列叙述正确的是( )
A.天然气是二级能源
B.热水器使用的太阳能是一级能源
C.手机中的使用的电池是一级能源
D.水电站发电利用的水能是二级能源难度: 中等查看答案及解析
-
已知原子序数,可以推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置.
A.①②③④⑥
B.①④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦难度: 中等查看答案及解析
-
下列说法正确的是( )
A.门捷列夫编制的第一张元素周期表是按相对原子质量由小到大依次排列的
B.第二周期元素的最高化合价为+1→+7
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数不一定相同难度: 中等查看答案及解析
-
1919年,科学家第一次实现了人类多年的梦想--人工转变元素.这个核反应如下:714N+24He→817O+11H,下列叙述正确的是( )
A.817O原子核内有9个质子
B.11H原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He和N2化学性质都很稳定难度: 中等查看答案及解析
-
下列化学变化中,反应物的总能量低于生成物的总能量的是( )
A.2H2+O2H2O
B.CaO+H2O=Ca(OH)2
C.CaCO═CaO+CO2↑
D.CH3CH2OH(酒精)+3O2CO2+3H2O
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.原电池中电子流出的极为负极,发生氧化反应
B.原电池是将电能转化为化学能的装置
C.原电池中阴离子向正极移动
D.原电池正极上发生氧化反应难度: 中等查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )

A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高难度: 中等查看答案及解析
-
n mol H2与n mol T2气体不同之处是( )
A.质量
B.原子数
C.电子数
D.体积(相同状况)难度: 中等查看答案及解析
-
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
A.正极发生得电子的氧化反应
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出难度: 中等查看答案及解析
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生N2+3H2
2NH3,有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零难度: 中等查看答案及解析
-
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )

A.a电极是负极,外电路中电子由a电极流向b电极
B.b电极的电极反应为氧化反应
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.CO2的电子式:
B.质量数为37的氯原子:Cl
C.NH4Cl的电子式:
D.原子核内有10个中子的氧原子:难度: 中等查看答案及解析
-
下列中和反应中放出热量最多的是( )
A.100mL0.3mol/L的HCl和50mL0.3mol/L的NaOH相混合
B.80mL0.3mol/L的HCl和80mL0.3mol/L的NaOH溶液相混合
C.80mL0.3mol/L的H2SO4和80mL0.3mol/L的NaOH溶液相混合
D.50mL0.3mol/L的H2SO4和50mL0.6mol/L的NaOH溶液相混合难度: 中等查看答案及解析
-
“嫦娥一号”成功发射,标志着我国实施绕月探测工程迈出重要一步.其任务之一是探测月球土壤厚度、探明氦-3储量.下列有关氦-3的说法中正确的是( )
A.原子结构示意图为:
B.原子核外电子数为2
C.1mol3He的质量约为3g
D.3He的摩尔质量为3难度: 中等查看答案及解析
-
设阿伏加德罗常数(NA)的数值为nA,下列说法错误的是( )
A.2g2H216O含有的共用电子对数目为0.4nA
B.3molNO2与足量H2O反应,转移的电子数为2nA
C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3nA
D.12.8g铜与含0.4molH2SO4的浓硫酸充分反应,生成的SO2气体分子数为0.2nA难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到限度的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1molX同时生成0.2molZ难度: 中等查看答案及解析
-
下列反应的能量变化属于放热反应的是( )
A.氢氧化钠溶液与盐酸反应
B.氯化铵与消石灰的反应
C.锌片与稀硫酸反应
D.碳单质与氧化铁的置换反应难度: 中等查看答案及解析
-
下列化学用语中,正确的是( )
A.磷酸的化学式:H2PO4
B.镁的原子结构示意图:
C.氯化钠的电子式:
D.甲烷的结构式:难度: 中等查看答案及解析
-
26、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

A.Y、Z的阴离子核外电子数之差为18
B.常压下,Y单质的沸点比Z单质的沸点低
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强难度: 中等查看答案及解析
-
硫酸是一种重要的化工产品,2SO2+O2
2SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是( )
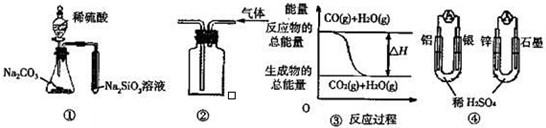
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应“CO(g)+H2O(g)⇌CO2(g)+H2(g)”为放热反应
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.干冰变为二氧化碳气体,需吸收能量,是因为共价键被破坏
B.碳酸氢铵是典型离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键
C.化学反应是吸热还是放热必须看反应物和生成物所具有的总能量的相对大小
D.共价化合物中一定只含共价键难度: 中等查看答案及解析