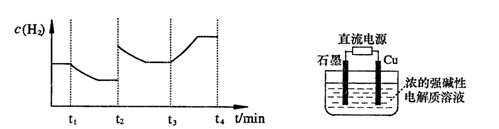
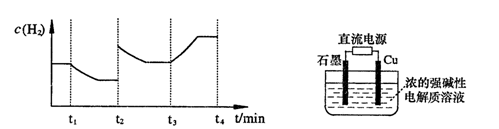
-
下列有关说法正确的是:( )
A. 由14N2和15N2组成的物质是混合物
B.在常温常压下,11.2L氧气所含的原子数目为NA
C.第三周期的元素从左往右非金属性逐渐增强
D.电解MgCl2饱和溶液,可制得金属镁
难度: 中等查看答案及解析
-
分子式为C4H8O2且能与NaOH溶液反应的有机物共有(不考虑立体异构):( )
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是 ( )
A.将甲烷通入溴水中能发生取代反应
B.乙烯双键中的一个键可以断裂,容易发生加成反应
C.乙酸是一种重要的有机酸,是一种无色无味的液体
D.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
难度: 中等查看答案及解析
-
化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:
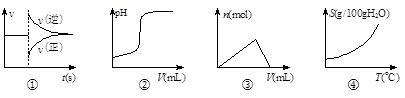
有关上述曲线图的说法正确的是( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的硫酸溶液中滴加一定浓度的氢氧化钠溶液时pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
难度: 中等查看答案及解析
-
有0.1 mol的Na2O和Na2O2混合物,溶于水后刚好被10 g 7.3%的盐酸中和,则混合物中Na2O与Na2O2的物质的量之比为 ( )
A.11∶1 B.2∶1 C.3∶4 D.任意比
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向0.1mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.常温下由水电离出来的c(H+) =10- 13mol/L的溶液: K+、HS-、Br-、Ba2+
C.将1mol FeCl3全部转化成胶体,其中氢氧化铁胶粒数为NA
D.0.lmol/L Fe2(SO4)3溶液中阴离子和阳离子总数等于0.1NA
难度: 中等查看答案及解析
-
水的电离平衡曲线如右图所示,下列说法不正确的是( )

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4C1固体的方法
D.若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性
难度: 中等查看答案及解析