-
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.01mol·L-1的NaOH溶液
B. 加入10mL 的水进行稀释
C. 加水稀释成100mL
D. 加入10mL 0.01mol·L-1的盐酸溶液
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中,正确的是( )
A. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的NaCl溶液,生成H2的速率不变
B. 用铁片和稀硫酸反应制取H2时,改用铁片和浓硫酸可以加快产生H2的速率
C. 二氧化硫的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
难度: 中等查看答案及解析
-
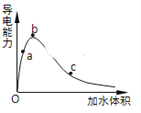
下列说法正确的是
A.强电解质溶液一定比弱电解质溶液导电能力强
B.BaSO4是弱电解质
C.蔗糖、CO2是非电解质
D.盐酸能导电,所以盐酸是电解质
难度: 中等查看答案及解析
-
室温下,不能说明HCO3-为弱电解质的是( )
A. 0.01mol·L-1 HCO3-溶液pH大于2 B. NaHCO3溶液显碱性
C. 向紫色石蕊试液中呼气,溶液变红色 D. 向Na2CO3溶液滴加醋酸,有气泡产生
难度: 中等查看答案及解析
-
下列物质中,既能导电又属于强电解质的一组物质是( )
A.石墨、食醋 B.液氨、石灰水
C.熔融MgCl2、熔融NaOH D.稀硫酸、蔗糖
难度: 中等查看答案及解析
-
向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42﹣)时,溶液的pH( )
A. 大于7 B. 等于7 C. 小于7 D. 无法判断
难度: 中等查看答案及解析
-
和
在溶液中有:2
(黄)+2H+
(橙)+H2O的转化。室温下初始浓度为1.0 mol/L的Na2CrO4溶液中c(
)随c(H+)的变化如图所示。不正确的是( )
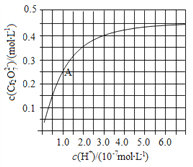
A. 向Na2Cr2O7溶液中加NaOH固体,溶液的颜色为黄色
B. 由图可知,溶液酸性增大,
的平衡转化率增大
C. 根据A点数据计算出该转化反应的平衡常数为1 (mol·L-1)-3
D. 温度升高,溶液中
的平衡转化率减小,则该反应为放热反应
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
难度: 中等查看答案及解析
-
反应CO(g) +H2O(g)
H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是
A. 升高温度 B. 减小压强 C. 加入CO D. 加入催化剂
难度: 中等查看答案及解析
-
在某温度下,反应ClF(g)+F2(g)
ClF3(g) ΔH=+268 kJ·mol-1,在密闭容器中达到平衡,下列说法中正确的是( )
A. 升高温度,K不变,平衡向正反应方向移动
B. 升高温度,平衡常数变小
C. 升高温度,平衡向正反应方向移动,F2的转化率提高
D. 降低温度,ClF3的产率提高
难度: 中等查看答案及解析
-
一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g)
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
难度: 中等查看答案及解析
-
下图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断 ( )
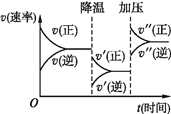
A. 正反应是吸热反应
B. 若A、B是气体,则D是液体或固体
C. 逆反应是放热反应
D. A、B、C、D均为气体
难度: 中等查看答案及解析
-
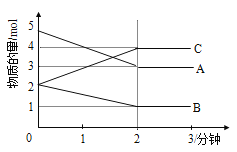
如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
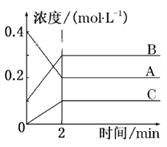
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)
2B(g)+C(g)
难度: 中等查看答案及解析
-
将NO2装入带有活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
难度: 中等查看答案及解析
-
下列电离方程式或水解方程式正确的是( )
A. H2S
2H++S2﹣ B. NaHSO4═Na++H++SO42﹣
C. CO32﹣+2H2O
H2CO3+2OH﹣ D. Al3++3H2O
Al(OH)3↓+3H+
难度: 简单查看答案及解析
-
在室温下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B.通入少量氯化氢气体
C.升高温度 D.加入少量氢氧化钠固体
难度: 中等查看答案及解析