-
下列说法不正确的是
A.2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代。利用此类光学显微镜可以观察活细胞内蛋白质等大分子。
B.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法
C.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法
难度: 中等查看答案及解析
-
下列说法正确的是
A.试管、烧杯、表面皿、蒸发皿、圆底烧瓶都能用酒精灯加热
B.用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH值
C.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液
D.用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大
难度: 中等查看答案及解析
-
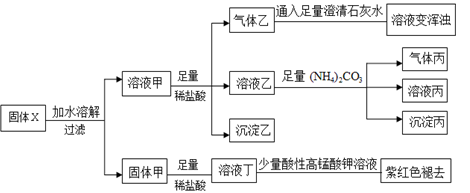
X、Y、Z、M、W五种短周期元素。X的质子总数与电子层数相同,Y、Z、M、W在周期表中的相对位置如下表,且W原子核外电子数是M原子最外层电子数的2倍。下列说法不正确的是
Y
Z
M
W
A.原子半径:W>Y>Z>M>X
B.X、Y、Z 三种元素形成的化合物中可能既有离子键又有共价键
C.W分别与M、Z元素形成的化合物WM4、WZ2都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
难度: 中等查看答案及解析
-
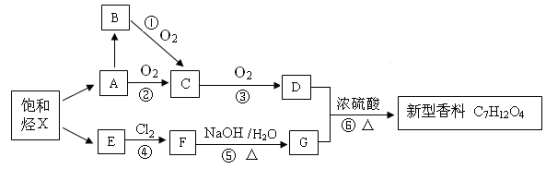
下列说法正确的是
A.还原性染料靛蓝的结构简式为:
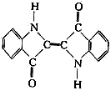 ,它的分子式是:C16H10N2O2
,它的分子式是:C16H10N2O2B.结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯
C.总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变
D.丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物
难度: 中等查看答案及解析
-
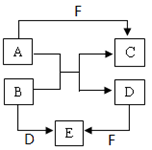
某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A.锂离子电池放电时Li+向正极迁移
B.镍氢电池放电时,正极的电极反应式:NiOOH+H2O +e-== Ni(OH)2+OH-
C.上图表示用锂离子电池给镍氢电池充电
D.锂离子电池充电时,阴极的电极反应式:LiMn2O4—xe-== Li1-xMn2O4+ xLi+
难度: 中等查看答案及解析
-
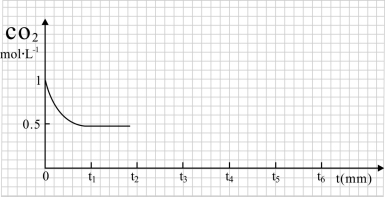
室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
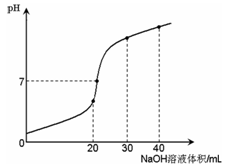
A.PH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)== c(NH3·H2O) + c(OH-)
D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
难度: 困难查看答案及解析