-
生产、生活离不开各种化学物质,下列说法不正确的是( )
A.“碳纳米泡沫”被称为第五形态的单质碳,它与石墨互为同素异形体
B.“神舟”七号宇航员所穿出舱航天服的主要成分是由碳化硅、陶瓷和纤维复合而成,它是一种新型无机非金属材料
C.蛋白质、油脂、塑料都是有机高分子化合物
D.2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为产品α)符合“绿色化学”的要求难度: 中等查看答案及解析
-
最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O2,太空中的甲醇(CH3OH)气团等,已知甲醇性质和乙醇相似.下列说法中正确的是( )
A.18O2和16O2是两种不同的核素
B.将ag铜丝灼烧成黑色后趁热插入甲醇中,铜丝变红,质量小于ag
C.CH3OH与CHOH发生反应的化学方程式为:CH3OH
CH
D.2N5═5N2是化学变化难度: 中等查看答案及解析
-
大胆科学的假设与猜想是科学探究的先导和价值所在.在下列假设(猜想)引导下的探究肯定没有意义的是( )
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究浓H2SO4与铜在一定条件下反应产生的黑色物质中可能有CuS
C.探究Na与水的反应生成NaOH和O2
D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性变化所致,还是HClO的漂白性所致难度: 中等查看答案及解析
-
下列实验与对应的结论不符合的是( )
A.
能证明非金属性Cl>C>Si
B.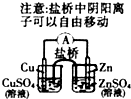
能组成Zn、Cu原电池
C.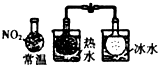
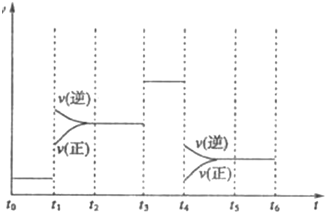
颜色深浅不同说明反应2NO2⇌N2O4,△H<0
D.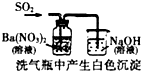
白色沉淀为BaSO4难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
A.同温同压下,等质量的CO与N2两种气体的体积相等
B.1L0.1mol/LNa2CO3溶液中阴离子总数大于0.1NA
C.46g的NO2和N2O4混合气体含有的原子数为3NA
D.71g氯气与足量的铁充分反应时,转移的电子数为3NA难度: 中等查看答案及解析
-
下列说法正确的是( )
A.碳酸钠溶液中存在:c(Na+)+c(H+)=+c(OH-)
B.pH相等时,①NH4Cl②c(NH4)2SO4③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③
C.等体积等浓度的氢氧化钠与醋酸混合后:c(Na+)=
D.25℃时,Al(OH)3固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小难度: 中等查看答案及解析
-
下列反应的离子方程式中正确的是( )
A.甲烷、氧气和氢氧化钾溶液组成的燃料电池的负极反应CH
B.在NaHSO4溶液中加Ba(OH)2至中性2H+=BaSO4↓+2H2O
C.氯化铝溶液与过量的氨水反应:Al3+4NH+4NH3•H2O=
D.碳酸氢根离子水【解析】
HCO+H2O⇌
难度: 中等查看答案及解析
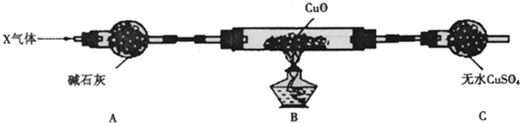

 ),常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
),常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.