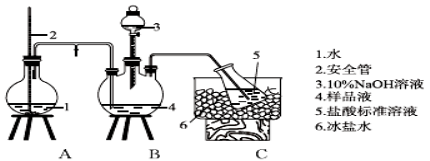
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅
B.工业上用石灰对煤燃烧后形成的烟气进行脱硫,并能回收得到石膏
C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
D.电解MgCl2溶液,可制得金属镁
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl-
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42-
C.能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3-
D.c(Al3+)=0.5 mol·L-1的溶液中:Na+、K+、AlO2-、SO42-
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH- 数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
难度: 中等查看答案及解析
-
下列图示实验合理的是

A.图1为证明非金属性强弱:S > C > Si
B.图2为制备少量氧气
C.图3为配制一定物质的量浓度的硫酸溶液
D.图4为制备并收集少量NO2气体
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为Cl2,则丁可能是铁 B.若甲为NH3,则丁可能是氧气
C.若甲为AlCl3溶液,则丁可能是氨水 D.若甲为NaOH,则丁可能是SO2
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是

A.1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2)
B.相对于途径①、②,途径③更好地体现了绿色化学理念
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
D.Y一定是葡萄糖
难度: 中等查看答案及解析
-
现将1mo1Cu2S与144g FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2 、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
A.4 mo1 B.5 mo1 C.6 mo1 D.7 mo1
难度: 中等查看答案及解析