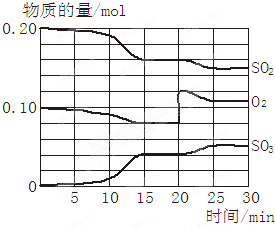
-
下列操作中,能使电离平衡H2O⇌H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入NaOH溶液
D.将水加热到100℃,使pH=6难度: 中等查看答案及解析
-
下列说法正确的是( )
A.所有放热反应都是自发反应
B.铁在潮湿空气中生锈是自发过程
C.熵增的反应都是自发反应
D.电解池反应均属于自发反应难度: 中等查看答案及解析
-
下列热化学方程式叙述正确的是(△H的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367KJ/mol (燃烧热)
B.NaOH(g)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3KJ/mol (中和热)
C.S(s)+O2(g)=SO2(g)△H=-269KJ/mol (反应热)
D.2NO2=O2+2NO△H=+116KJ/mol (反应热)难度: 中等查看答案及解析
-
在5.0mlNaCl溶液中加入3滴AgNO3溶液,有白色沉淀生成;再加入3滴KI溶液沉淀转化为黄色,然后再加入3滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶度积由大到小的顺序正确的是( )
A.Ag2S AgI AgCl
B.AgCl AgI Ag2S
C.AgI AgCl Ag2S
D.AgCl Ag2S AgI难度: 中等查看答案及解析
-
25℃,在0.01mol•L-1的硫酸溶液中,水电离出的H+浓度是( )
A.5×10-13mol•L-1
B.0.02mol•L-1
C.1×10-7mol•L-1
D.1×10-12mol•L难度: 中等查看答案及解析
-
将AlCl3溶液和NaAlO2溶液分别蒸发并灼烧,所得产物的主要成份是( )
A.均为Al(OH)3
B.前者得Al2O3,后者得NaAlO2
C.均为Al2O3
D.前者得AlCl3,后者得NaAlO2难度: 中等查看答案及解析
-
下列各组物质中,全部是弱电解质的一组是( )
A.MgCl2 HClO H2S
B.SO2 NH3 CH3COOH
C.NH3•H2O H2O H3PO4
D.H2SO4 HNO3 NaOH难度: 中等查看答案及解析
-
某同学的实验报告中有如下数据,其中数据合理的是( )
A.用托盘天平称取3.25gNaCl
B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸
D.用容量瓶配制200mL0.1mol/L的NaOH溶液难度: 中等查看答案及解析
-
如图所示,下列叙述正确的是( )

A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红难度: 中等查看答案及解析
-
将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108
B.108:35.5
C.8:1
D.1:2难度: 中等查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)=H2O(l)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(l)
C.CH3OH(g)+H2O(l)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(l)+4e-=4OH-难度: 中等查看答案及解析
-
在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa混合溶液中,测得c(CH3COO-)>c(Na+)则下列关系式正确的是( )
A.c(H+)>c(OH-)
B.c(OH-)>c(H+)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02mol/L难度: 中等查看答案及解析
-
下列各离子组中,因相互促进而强烈水解不能大量共存的离子组是( )
A.H2PO4-、Na+、Cl-、OH-
B.Al3+、Na+、HCO3-、SO42-
C.H+、Fe2+、NO3-、SO42-
D.S2-、Na+、Cl-、Al3+难度: 中等查看答案及解析
-
如图a、b、C.d均为石墨电极,通电进行电解.
下列说法正确的是( )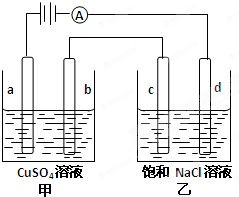
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,C电极附近变红
C.向乙中通人适量HCl气体溶液组成可以恢复
D.当b极有64gCu析出时,C电极产生2g气体难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )

A.负极电极反应式为:Fe-3e-=Fe3+
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu难度: 中等查看答案及解析
-
温度不变时,向饱和BaSO4溶液中加水,下列叙述正确的是( )
A.BaSO4的溶解度不变,Ksp不变
B.BaSO4的溶解度减小,Ksp增大
C.BaSO4的溶解度不变,Ksp增大
D.BaSO4的溶解度增大,Ksp不变难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强难度: 中等查看答案及解析