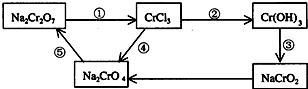
-
分类方法在化学教材必修I中出现,下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
A.①②
B.②④
C.①③
D.③④难度: 中等查看答案及解析
-
已知 2Fe3++2I-=2Fe2++I2,2Fe2++Cl2=2Fe3++2Cl-,则有关离子的还原性由强到弱的顺序为( )
A.Cl->Fe2+>I-
B.Fe2+>I->Cl-
C.I->Fe2+>Cl-
D.Fe2+>Cl->I-难度: 中等查看答案及解析
-
摩尔是( )
A.国际单位制的一个基本物理
B.计量微观粒子的物质的量的单位
C.表示物质质量的单位
D.表示6.02×1023个粒子的集体难度: 中等查看答案及解析
-
下列变化需加入还原剂才能完成的是( )
A.KMnO4→MnO2
B.HCO3-→CO2
C.H2SO4→SO2
D.Br-→Br2难度: 中等查看答案及解析
-
依据常用危险化学品分类,下列选项正确的是( )
A. 氢氧化钾
氢氧化钾
B. 高锰酸钾
高锰酸钾
C. 红磷
红磷
D. 浓硫酸
浓硫酸 难度: 中等查看答案及解析
-
下列有关实验操作的说法正确的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用稀盐酸溶液洗涤并灼烧铂丝后,再进行焰色反应
D.用CCl4萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法中正确的是( )
A.常温常压下,16g氧气和臭氧(O3)的混合气体中含有NA个氧原子
B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
C.12gNaHSO4在熔融时离子总数为0.3NA个
D.标准状况下,11.2L氦气所含的原子数为NA个难度: 中等查看答案及解析
-
下列事实与胶体无关的是( )
A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B.将NaCl研磨成直径在1~100nm的颗粒然后分散于水中形成的分散系
C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通道
D.氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解难度: 中等查看答案及解析
-
某一化学兴趣小组的同学在家中进行实验,按照图甲连接好线路,发现灯泡没亮,但是按照图乙接好路线,灯泡亮了.由此得出的以下结论中正确的是( )
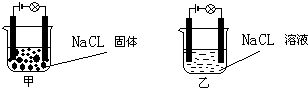
A.NaCl是非电解质
B.NaCl溶液是电解质
C.在NaCl溶液中,水电离出了大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子难度: 中等查看答案及解析
-
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.NaHCO3溶液中加足量石灰水:HCO3-+OH-+Ca2+=CaCO3↓+H2O
B.钠与水反应:Na+2H2O=Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.铁片投入稀盐酸中:2Fe+6H+=2Fe3++3H2↑难度: 中等查看答案及解析
-
在C(HCO3-)=0.1mol•L-1的溶液中,可以大量共存的离子组是( )
A.Ca2+、NO3-、NH4+、Cl-
B.Na+、SO42-、C1-、Ca2+
C.H+、Ba2+、Cl-、NO3-
D.Cl-、CO32-、Na+、OH-难度: 中等查看答案及解析
-
某NaOH溶液的溶质质量分数是10%,则此溶液中Na+与H2O的个数比为( )
A.1:10
B.1:20
C.1:11.5
D.1:23难度: 中等查看答案及解析
-
阅读、分析下列材料:
试回答:将乙二醇和丙三醇相互分离的最佳方法是( )物质 熔点/℃ 沸点/℃ 密度/g•cm-3 溶解性 乙二醇( C2H6O2) -11.5 198 1.11 易溶于水和乙醇 丙三醇(C3H8O3) 17.9 290 1.26 能跟水、酒精以
任意比互溶
A.蒸馏法
B.萃取法
C.“溶解、结晶、过滤”的方法
D.分液法难度: 中等查看答案及解析
-
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:4
B.1:2
C.2:1
D.4:1难度: 中等查看答案及解析
-
在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,还原产物和氧化产物的质量之比是( )
A.5:3
B.3:5
C.5:4
D.1:1难度: 中等查看答案及解析
-
甲、乙、丙、丁四种易学溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/l乙溶液中c(H+)>0.1mol/l;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.
下列结论不正确的是( )
A.甲溶液含有Ba2+
B.乙溶液含有SO42-
C.丙溶液含有Cl-
D.丁溶液含有Mg2+难度: 中等查看答案及解析
-
某地甲、乙两工厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ca2+、Fe2+、Na+、Cl-、CO32-、NO3-、OH-.若两厂单独排放污水都会造成较严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低.根据所给信息有以下几种说法,你认为正确的是( )
A.Na+和NO3-来自同一工厂
B.Cl-和NO3-一定来自同一工厂
C.Ag+和Na+可能来自同一工厂
D.CO32-和OH-一定来自同一工厂难度: 中等查看答案及解析