-
化学与生活、社会发展息息相关。下列说法不正确的是
A. 用SO2漂白过的草帽日久会变色
B. 用天燃气代替煤作燃料可减少大气污染
C. “84消毒液”杀死病菌是因为蛋白质变性
D. 乙醇用作医用消毒剂时,无水乙醇消毒效果最好
难度: 简单查看答案及解析
-
下列实验装置或操作正确的是
A
B
C
D
 除去附着在铁屑
除去附着在铁屑
表面的铝
实验室制取乙酸乙酯
实验室制乙烯
分离酒精和水难度: 中等查看答案及解析
-
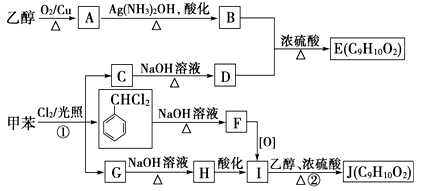
有关下图所示化合物的说法不正确的是

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
难度: 中等查看答案及解析
-
200mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=1.4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体2.24L(标准状况下),假定电解后溶液体积仍为200 mL,下列说法正确的是
A. 原混合溶液中c(Na+)=0.9 mol·L-1
B. 电解后溶液的pH值为0
C. 上述电解过程中共转移0.8 mol电子
D. 电解后得到的Cu的物质的量为0.2mol
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法中正确的是
A. 常温下28g乙烯中所含极性键的数目为4NA
B. 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+
C. 标准状况下,22.4L甲醇中所含羟基数为NA
D. 10L pH=1的硫酸溶液中含有的H+离子数为2NA
难度: 中等查看答案及解析
-
X 、Y 、Z 、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z 元素金属性最强,R原子的核外电子数是X、Z核外电子数之和。下列叙述一定正确的是
A. 含氧酸酸性R>X
B. 简单氢化物稳定性Y<X
C. 由Z和R形成的化合物为离子化合物
D. 最高正化合价Z< X <Y< R
难度: 简单查看答案及解析
-
在2L恒容密闭容器中充入M (g)和N (g),发生反应M (g) +N (g)
2P (g) +Q (s),所得实验数据如下表:

下列说法正确的是
A. 实验①中,若5 min时测得n(N) = 0.050 mol,则0~5min时间内平均反应速率v(P) = 0.015 mo1/(L·min)
B. 实验②中达到平衡后,增大压强,M的转化率增大,平衡常数不变
C. 600℃时该反应的平衡常数K=3.0
D. 实验③中,达到平衡时,x<0.10
难度: 困难查看答案及解析

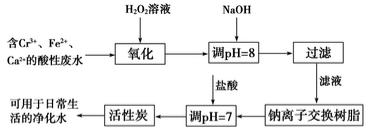
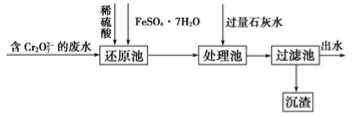


 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O CH2===CH2↑+H2O
CH2===CH2↑+H2O