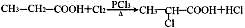-
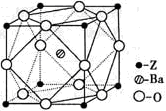
下列化学式只能表示一种物质的是
A. P B. C4H10 C. C2H4Cl2 D. CH2Cl2
难度: 简单查看答案及解析
-
.按照物质的树状分类和交叉分类,HNO3应属于
①酸②氢化物③氧化物④含氧酸⑤难挥发性酸⑥强氧化性酸⑦一元酸⑧化合物⑨混合物
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧ C.①⑨ D.①④⑤⑥⑦
难度: 简单查看答案及解析
-
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5 种盐的是
A.Al2O3、SO2、CO2、SO3 B.Cl2、Al2O3、N2O5、SO3
C.CO2、Cl2、CaO、SO3 D.SiO2、N2O5、CO、Cl2
难度: 简单查看答案及解析
-
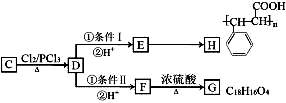
苯甲酸(C6H5COOH)和山梨酸(CH3—CH CH—CH CH—COOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是
A.金属钠 B.氢氧化钠 C.溴水 D.乙醇
难度: 简单查看答案及解析
-
在一密闭容器中充入一种气态烃和足量的氧气,用电火花点燃完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃和相同的压强下测定的,这种气态烃是
A. CH4 B. C2H6 C. C2H2 D. C3H6
难度: 简单查看答案及解析
-
设阿伏加德罗常数为NA,下列说法正确的是
A.1molCnH2n+2烃分子中,含有碳碳键数目为n NA
B.一定条件下,密闭容器中加入2molSO2、1molO2发生反应2SO2+O2
2SO3,转移的电子数目为4NA
C.53g碳酸钠固体中,碳酸根离子的数目为0.5 NA
D.2g重氧水(H218O)中的中子数为0.8 NA
难度: 简单查看答案及解析
-
下列各元素中,一定属于主族元素的是
A.X元素能形成+7价的含氧酸及其盐
B.Y元素原子最外层电子数为2
C.Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同
D.R元素的最高价氧化物是酸性氧化物
难度: 简单查看答案及解析
-
现有三组混合液:①乙酸乙酯和乙酸钠溶液,②乙醇和丁醇,③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.分液、蒸馏、萃取
C.萃取、蒸馏、分液 D.蒸馏、萃取、分液
难度: 简单查看答案及解析
-
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g)
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A. pH=2 的溶液:Fe 3+、Cu2+、 SO42-、NO3-
B. c(H+)=1×10-12mol·L-1的溶液:NH4+、K+、Cl-、AlO2-
C.水电离的c(H+)=1×10-12mol·L-1的溶液:Na+、Al3+、Br-、ClO-
D.与铝反应放出氢气的溶液:Na+ .Mg2+、Br-、Cl-
难度: 简单查看答案及解析
-
某温度下,相同pH、相同体积的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是
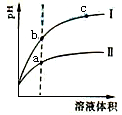
A.Ⅱ为盐酸稀释时pH变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点
的数值比c点
的数值大
D.b点酸的总浓度大于a点酸的总浓度
难度: 简单查看答案及解析
-
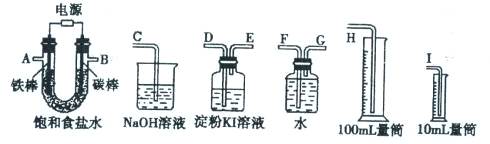
某原电池装置如图所示。下列有关叙述中,正确的是
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
难度: 简单查看答案及解析
-
将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A.④③②① B.②③④① C.①④③② D.①③②④
难度: 简单查看答案及解析
-
下列化学方程式书写正确的是
A.纯碱用于清洁厨具是由于它溶于水呈碱性: CO2-3+H2O
H2CO3+OH—
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:
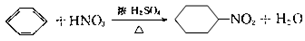
C.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
D.以石墨为电极电解MgCl2溶液:2Cl—+2H2O
Cl2↑+H2↑+2OH—
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D.向NaHCO3 溶液中加入过量Ca(OH)2 溶液
2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-
难度: 简单查看答案及解析
-
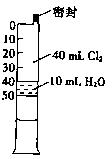
如图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2
2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是

A.20% B.40% C.60% D.无法确定
难度: 简单查看答案及解析