-
下列原子或离子原子核外电子排布不属于基态排布的是
A. Na: 1s22s22p53s2 B. S2-: 1s22s22p63s23p6
C. N: 1s22s22p3 D. Si: 1s22s22p63s23p2
难度: 简单查看答案及解析
-
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A. 1s22s22p63s23p3→1s22s22p63s23p2
B. 1s22s22p63s23p2→1s22s22p63s23p1
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
难度: 简单查看答案及解析
-
以下各微粒中,所有原子都满足最外层为8电子结构的是 ( )
A.H3O+ B.BF3 C.PCl5 D.CCl4
难度: 简单查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化, CH4是sp3型杂化
B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
C.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道。
D.氨气分子是极性分子而甲烷是非极性分子。
难度: 简单查看答案及解析
-
现有四种晶体,其离子排列方式如图所示,其中化学式不属于AB型的是
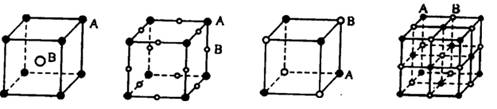
A B C D
难度: 简单查看答案及解析
-
下列现象与氢键有关的是:
①NH3的熔、沸点比VA族其它元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
难度: 简单查看答案及解析
-
下列说法不正确的是
A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大。
B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小。
C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。
D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力。
难度: 简单查看答案及解析
-
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是
A.三氯化硼液态时能导电而固态时不导电
B.三氯化硼加到水中使溶液的pH升高
C.三氯化硼分子呈正三角形,属非极性分子
D.三氯化硼遇水蒸气会产生白雾
难度: 简单查看答案及解析
-
下列配合物的配位数不是6的是
A、K2[Co(SCN)4] B、Na2[SiF6] C、Na3[AlF6] D、[Cu(NH3)4]Cl2
难度: 简单查看答案及解析
-
下列说法中错误的是
A、原子及其离子的核外电子层数等于该元素所在的周期数;
B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素;
C、除氦外的稀有气体原子的最外层电子数都是8;
D、同一元素的各种同位素的物理性质、化学性质均相同
难度: 简单查看答案及解析
-
下列有关元素锗及其化合物的叙述中正确的是
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有原子晶体结构的单质
难度: 简单查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSi02中含Si—O键的个数为2NA
难度: 简单查看答案及解析
-
1995年美国Lagow教授报道,他制得了碳的第四种同素异形体——链式炔碳:
,该物质的一个分子中含有300~500个碳原子,性质很活泼。下列关于该链式炔碳的熔点判断正确的是( )
A.比石墨高 B.比石墨低
C.低于石墨而高于金刚石 D.无法判断
难度: 简单查看答案及解析

