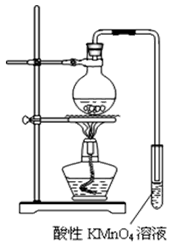
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA
B.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA
C.46g NO2和N2O4的混合气体中含N原子总数为NA
D.等物质的量的NH4+和OH-含电子数均为10NA
难度: 中等查看答案及解析
-
胆固醇是人体必需的生物活性物质,分子式为C25H46O。已知某种胆固醇酯是液晶材料,分子式为C32H50O2。则生成这种胆固醇酯的酸是
A.C6H13COOH B.C6H5COOH C.C7H15COOH D.C6H5CH2COOH
难度: 中等查看答案及解析
-
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是

A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH均变大。
难度: 困难查看答案及解析
-
下列说法正确的是
A.用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
B.煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离
C.聚氯乙烯塑料可制作保鲜膜、一次性食品袋
D.聚乙烯塑料的老化是由于发生了加成反应
难度: 中等查看答案及解析
-
中和热是在稀溶液中,强酸、强碱发生中和反应生成1 mol水时放出的热量,中和热为57.3 kJ/mol。下列热化学方程式中正确的是
A.HNO3(aq)+KOH(aq)= H2O(l)+KNO3(aq)
H>-57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)= H2O(l)+NH4NO3(aq)
H<-57.3 kJ/mol
C.CH3COOH(aq)+KOH(aq)= H2O(l)+CH3COOK(aq)
H<-57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)= H2O(l)+CH3COONH4(aq)
H>-57.3 kJ/mol
难度: 中等查看答案及解析
-
天然维生素P(结构如图,结构中R为烷基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是

A.1 mol该物质与足量溴水反应消耗6 mol Br2
B.1 mol该物质可与5 molNaOH反应
C.分子内所有原子可能在同一平面上
D.若能使酸性KMnO4溶液的紫色褪去,则可证明该物质分子中含有碳碳双键
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,反应过程如图,下列说法正确的是
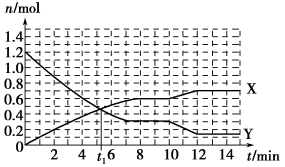
A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的平均反应速率v(H2)=0.01 mol·L-1·min-1
D.10~12 min,升高温度使反应速率加快,平衡正向移动
难度: 中等查看答案及解析