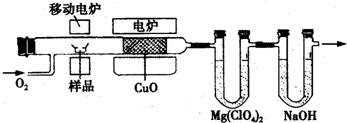
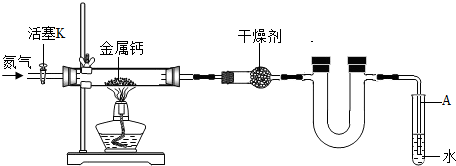
-
传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质.假设用醋酸的质量分数为3%的半成醋,生产500g 5.4%的优级醋,过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为( )
A.500g
B.400g
C.200g
D.100g难度: 中等查看答案及解析
-
下列实验不能达到目的是( )
A.
测定一定时间内生成H2的反应速率
B.
用CO2做喷泉实验
C.
验证NH3易溶于水
D.
比较Na2CO3与NaHCO3的热稳定性难度: 中等查看答案及解析
-
含有相同质子数和核外电子数的两种粒子,可能是( )
A.两种不同元素的原子
B.两种不同的分子
C.一种阳离子、一种阴离子
D.一种原子、一种离子难度: 中等查看答案及解析
-
欲除去氯化钙溶液中的少量盐酸,在没有指示剂的条件下应选用的试剂是( )
A.碳酸钙粉末
B.生石灰粉末
C.熟石灰粉末
D.硝酸银溶液难度: 中等查看答案及解析
-
化合物A为一种盐,分析表明A中部分元素的质量分数为:Cu 39.50%、N 8.64%,其余为H、O、S.A与NaOH混合时有能使湿润的红色石蕊试纸变蓝的气体产生,则A的化学式为( )
A.CuNH4SO3
B.Cu(NH4)2(SO4)2
C.Cu3(NH4)2(SO4)3
D.Cu(NH4)2(S2O3)2难度: 中等查看答案及解析
-
某溶液中仅含H+、Fe3+、NO3-和M(未知)4种离子,其个数比为2:1:3:1,则M离子为( )
A.Na+
B.Cl-
C.SO42-
D.CO32-难度: 中等查看答案及解析
-
由Mg、Al、Fe、Cu四种金属中的两种或多种所组成的混合物20g,与足量的稀硫酸完全反应,共产生2gH2,则原混合物组成的所有可能组合数为( )
A.3种
B.6种
C.7种
D.9种难度: 中等查看答案及解析
-
密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示:
下列说法不正确的是( )物质 A B C D 反应前质量/g 2 2 84 5 反应后质量/g 待测 24 14
A.物质C一定不是单质
B.物质B、C、D不可能均为化合物
C.该反应属于分解反应
D.若A与C的相对分子质量之比为53:42,则反应中A与C的化学计量数之比为1:2难度: 中等查看答案及解析