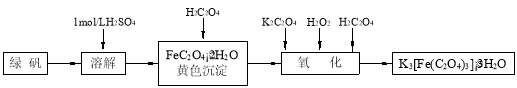
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA。
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
从某些性质看,NH3和H2O,NH4+和H3O+,OH-和NH2-,N3-和O2-两两相当,据此判断下列反应方程式正确的是
①2Na + 2NH3
2NaNH2 + H2↑ ②CaO + 2NH4Cl
CaCl2 + 2NH3↑+ H2O
③3Mg(NH2)2
Mg3N2 + 4NH3↑ ④NH4Cl + NaNH2
NaCl + 2NH3(l)
A.仅①正确 B.②④正确 C.全部正确 D.①②④正确
难度: 中等查看答案及解析
-
下列实验过程和过程中涉及的离子反应方程式肯定正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2+ + Cl2
2Fe3+ + 2Cl-
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO + Br2
CH2Br-CHBr-CHO
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2+ + 2OH-+ NH4+ + H+ + SO42-
BaSO4↓ + NH3·H2O + H2O
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2 + 4Fe2+ + 6H2O
4Fe(OH)3 ↓+ 8Na+ + O2↑
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=12的溶液中:AlO2-、Na+、SO 4 2-、SO32-
B.水电离出的c(H+)=10-12mol/L的溶液中:K+、Na+、SO 4 2-、AlO2-
C.能与铝反应生成氢气的溶液中:Mg2+、Na+、Cl-、NO3-
D.c(H+)=0.10mol/L的溶液中:CH3COO-、NH4+、Cl-、Na+
难度: 中等查看答案及解析
-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y->CO32->X->HCO3-
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素
C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成
D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物
难度: 中等查看答案及解析
-
LiAlH4(
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
A.LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B.1 mol LiAlH4在125℃完全分解,转移3 mol电子
C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4 + 2H2O
LiAlO2 + 4H2↑
D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
难度: 中等查看答案及解析
-
下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
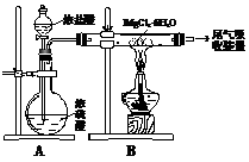
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl2•6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
难度: 中等查看答案及解析
-
某芳香化合物的分子式为C8H8Cl2O2,其分子结构中有三种不同化学环境的氢,它们的数目之比为6︰1︰1,且分子中的Cl原子皆形成C-Cl键,则其可能的结构有(不考虑O与O相连接)
A.2种 B.3种 C.4种 D.5种
难度: 简单查看答案及解析
-
有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是

A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl-的物质的量相同
难度: 中等查看答案及解析
-
已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11下列说法正确的是
A.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大
B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体
C.25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp大
D.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2
难度: 中等查看答案及解析
-
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子。某同学对溶液进行了如下实验:
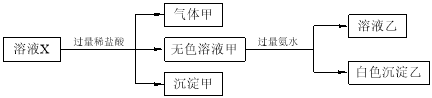
下列判断错误的是
A.有气体甲生成,表明溶液X中一定含有CO32-
B.沉淀甲不可能是硅酸镁
C.Al3+一定存在于溶液X中
D.不可能确定SO42-是否存在于溶液X中
难度: 中等查看答案及解析
-
As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3-
2H3AsO4 + 3S + 10NO2↑+ 2H2O,下列说法正确的是
A.生成1mol H3AsO4时,转移电子个数为10NA
B.将该反应设计成一原电池,则NO2应该在正极附近逸出
C.该反应的氧化产物之一为S
D.反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化为浓HNO3,然后与过量的碳反应,所产生的CO2的量为0.5mol
难度: 中等查看答案及解析
-
关于下列各图的叙述中正确的是
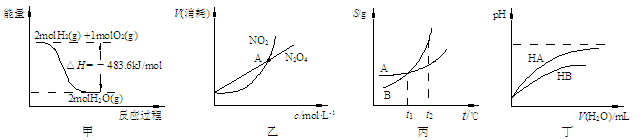
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
难度: 中等查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g) + xB(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器
甲
乙
丙
容积
0.5L
0.5L
1.0L
温度/℃
T1
T2
T2
反应物
起始量
1.5molA
0.5molB
1.5molA
0.5molB
6.0molA
2.0molB

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
难度: 困难查看答案及解析