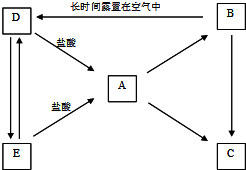
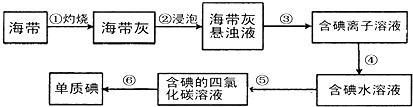
-
据科学家预测,月球的土壤中吸附着数百万吨的32He.而地球上氦元素主要以42He的形式存在.下列说法正确的是( )
A.32He和31H互为同位素
B.42He原子核内含有4个质子
C.32He原子核内含有1个中子
D.42He的最外层电子数为2,所以He元素属于金属元素难度: 中等查看答案及解析
-
下列物质中,既属于电解质又能导电的是( )
A.二氧化硫
B.NaOH溶液
C.石墨
D.熔融的KNO3难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4 L三氧化硫中含有的分子数为NA
B.0.5 mol•L-1的Na2SO4溶液中,含有Na+的个数为NA
C.标准状况下,22.4L二氧化硫与22.4L氧气所含的原子总数均为2NA
D.32 g 氧气所含的氧原子数目为2NA难度: 中等查看答案及解析
-
下列反应中,水作为还原剂的是( )
A.2F2+2H2O═4HF+O2
B.Na2O+H2O═2NaOH
C.Br2+H2O⇌HBr+HBrO
D.2Na+2H2O═2NaOH+H2↑难度: 中等查看答案及解析
-
胶体区别于其他分散系的本质特征是( )
A.分散质粒子能作不停的、无规则的运动
B.光线透过时能观察到光亮的通路
C.静置后既不分层,也无沉淀产生
D.分散质粒子直径在10-9~10-7 m之间难度: 中等查看答案及解析
-
某阳离子R2+核外有X个电子,质量数为A,则该离子核内中子数为( )
A.A-X
B.A-X+2
C.A-X-2
D.A+X-2难度: 中等查看答案及解析
-
下列各组离子,在酸性溶液中能大量共存的是( )
A.SO42-、I-、ClO-、Na+
B.Na+、AlO2-、Cl-、K+
C.Mg2+、SO42-、Cl-、Al3+
D.NO3-、Ag+、NH4+、I-难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.常温下氯气与NaOH溶液反应:Cl2+2OH -═Cl-+ClO-+H2O
B.FeCl3溶液中加入铜粉:Fe3++Cu═Fe2++Cu2+
C.铜与浓硫酸反应:Cu+4H++SO42-═Cu2++SO2↑+2 H2O
D.实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.目前工业上主要采用接触法制硫酸
B.目前工业上主要采用电解熔融的氧化镁制备镁单质
C.“氯碱工业”是以电解食盐水为基础制取氯气和氢氧化钠的工业
D.工业上用CO还原赤铁矿(主要成分为Fe2O3)冶炼金属铁难度: 中等查看答案及解析
-
下列溶液中的Cl-与50mL 1mol•L-1 AlCl3溶液中Cl-物质的量浓度相等的是( )
A.150mL 1mol•L-1的NaCl溶液
B.50mL 3mol•L-1NH4Cl溶液
C.50mL 2mol•L-1的FeCl3溶液
D.75mL 2mol•L-1的KCl溶液难度: 中等查看答案及解析
-
下列不能通过化合反应而制得的物质是( )
A.CuCl2
B.FeCl2
C.Cu (OH)2
D.Fe(OH)3难度: 中等查看答案及解析
-
下列溶液通入过量的CO2气体的过程中,一直出现没有浑浊的是( )
A.CaCl2溶液
B.Ca(ClO)2溶液
C.NaAlO2溶液
D.饱和Na2CO3溶液难度: 中等查看答案及解析
-
下列实验方法或结论中,不正确的是( )
A.用焰色反应能鉴别NaCl、KCl和Na2SO4三种物质
B.向某溶液中加入KSCN溶液变红色,说明该溶液中含有Fe3+
C.将溴水倒入分液漏斗,加适量四氯化碳,振荡后静置,可将溴萃取到四氯化碳中
D.某无色溶液中加入稀盐酸,无明显现象,再加BaCl2溶液,有白色沉淀生成,则该溶液中一定含有SO42-难度: 中等查看答案及解析
-
下列实验操作或方法中,正确的是( )
A.
将NaOH溶液存
B.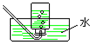
收集HCl气体
C.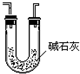
干燥SO2气体
D.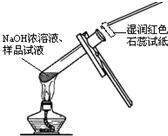
检验试液中NH4+的存在在玻璃滴瓶中难度: 中等查看答案及解析
-
有镁、铝混合粉末10.2g,将它溶于600mL 2mol•L-1的盐酸中,若要使沉淀质量达到最大值,则需加入2mol•L-1氢氧化钠溶液的体积为( )
A.120 mL
B.600 mL
C.1200 mL
D.1800 mL难度: 中等查看答案及解析
-
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )

A.1:3
B.2:3
C.3:2
D.1:4难度: 中等查看答案及解析