-
下列说法正确的是 ( )
A.在使用浓硝酸时,如不慎溅到皮肤上,皮肤会显黄色,是由于浓硝酸与蛋白质发生了颜色反应
B.酸性食物指的是在味觉上具有酸味的食物
C.光导纤维、玻璃纤维、合成纤维都属于高分子化合物
D.解决“白色污染”最有效的办法是直接焚烧,可回收热能用于加热或发电等
难度: 中等查看答案及解析
-
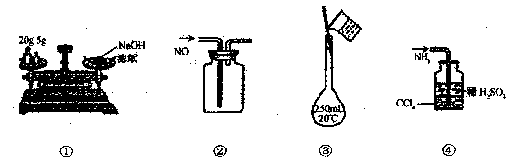 下列各图所示的实验方法正确的是 ( )
下列各图所示的实验方法正确的是 ( )A.①称量氢氧化钠固体 B.②收集NO气体
C.③配制100mL 0.10mol/L 盐酸 D.④吸收多余的NH3
难度: 简单查看答案及解析
-
下列叙述不正确的是 ( )
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.一定温度下,IL lmol/L的氨水与2L 0.5moFL的氨水中,n(NH4+)前者多
C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸
D.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-)
难度: 中等查看答案及解析
-
镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2 Mg2++2H2O。关于该电池说法正确的是( )
A.放电时H+在正极反应得电子
B.正极反应式为:H2O2+2e- 2OH-
C.镁合金为屯池负极,发生氧化反应
D.电池工作时,电解质溶液的pH降低
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.1mol铁粉与足量的高温水蒸气作用,生成的H2分子数为0.1NA
B.室温,IL pH=4的醋酸溶液中,由水电离产生的H+为l0-4NA
C.0.1 mol甲基(-CH3)所含质子数为9NA
D.标准状况下,22.4LCH2Cl2中含有的Cl原子数为2NA
难度: 中等查看答案及解析
-
将l1.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体X的成分可能是 ( )
A.0.3mol NO2和0.3mol NO
B.0.1mol NO、0.2mol NO2 和0.05mol N2O4
C.0.2mol NO2和0.1mol N2O4
D.0.6mol NO
难度: 困难查看答案及解析
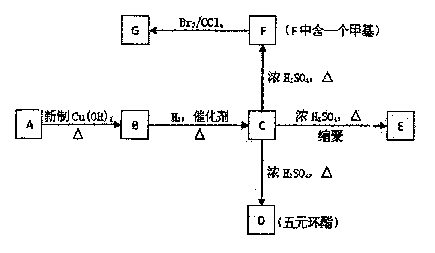 某烃的衍生物A的蒸汽密度是相同条件下氢气的50倍,其中碳、氢元素的含量共为68%,其余为氧元素。A中碳链无支链,1 mol A能与2 mol H2发生加成反应,但不能与溴水发生加成反应。根据下面的转化关系回答下列问题。
某烃的衍生物A的蒸汽密度是相同条件下氢气的50倍,其中碳、氢元素的含量共为68%,其余为氧元素。A中碳链无支链,1 mol A能与2 mol H2发生加成反应,但不能与溴水发生加成反应。根据下面的转化关系回答下列问题。 (2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
(2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。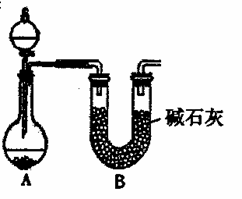 ⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.________;
⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.________;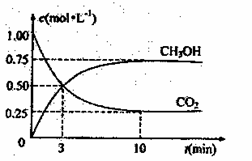 CH3OH(g)的浓度随时问变化如右图所示。
CH3OH(g)的浓度随时问变化如右图所示。