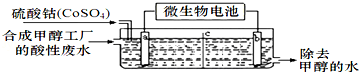
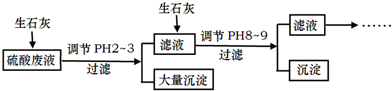
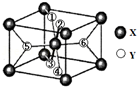
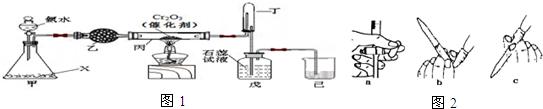
-
化学“暖手袋”是充满过饱和醋酸钠溶液的密封塑胶袋,袋内置有一个合金片.当合金片轻微震动使溶质结晶,该过程放热.下列说法不正确的是( )
A.彩色密封塑胶袋能造成白色污染
B.钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠
C.化学变化都伴随着能量的变化
D.大多数合金比各成分金属硬度小,熔点低
难度: 中等查看答案及解析
-
下列有关原子结构、元素性质的说法正确的是( )
A.Si、P、S、Cl元素的单质与氢气化合越来越容易
B.元素原子最外层电子数越多,元素金属性越强
C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是( )
A.糖类、油脂、蛋白质一定都能发生水解反应
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.一定条件下,理论上1mol苯和1mol甲苯均能与3molH2反应
D.乙醇、乙酸均能与NaOH稀溶液反应,因为分子中均含有官能团“﹣OH”
难度: 中等查看答案及解析
-
将10.7gMg、Al和Fe组成的合金溶于足量的氢氧化钠溶液中,产生标准状况下3.36L气体.另取等质量的合金溶于过量盐酸中,生成标准状况下7.84L气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀物质的量为( )
A.0.1mol B.0.2mol C.0.25mol D.0.3mol
难度: 简单查看答案及解析
-
某溶液可能含有Na+、Fe3+、Br﹣、I﹣、HCO3﹣、SO32﹣、NO3﹣等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是( )
A.Na+、I﹣、SO32﹣ B.Na+、Br﹣、SO32﹣
C.Fe3+、Br﹣、NO3﹣ D.Na+、Br﹣、NO3﹣
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.水的电离过程是吸热过程,升高温度,水的离子积常数增大,pH减小
B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象
C.向1ml浓度均为0.05mol•L﹣1的NaCl、NaI混合溶液中滴加2滴0.01mol•L﹣1的AgNO3溶液,震荡,沉淀呈黄色,结论,Ksp(AgCl)<Ksp(AgI)
D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化
难度: 中等查看答案及解析
-
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)⇌C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )
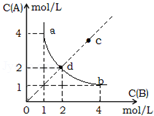
A.T°C时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T°C
D.T°C时,直线cd上的点均为平衡状态
难度: 中等查看答案及解析