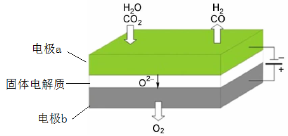
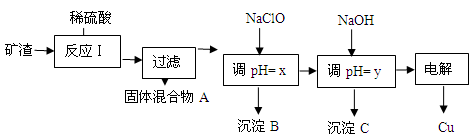
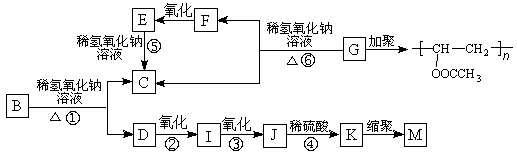
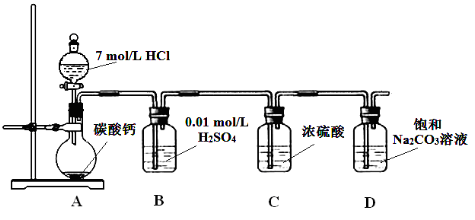
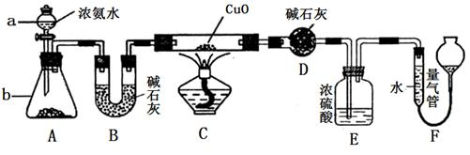
-
下列实验现象可用同一原理解释的是
A.品红溶液中分别通入SO2和Cl2,品红均褪色
B.溴水分别滴入植物油和裂化汽油中,溴水均褪色
C.鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.糖类化合物都具有相同的官能团
B.乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油”
C.蛋白质的水解产物都含有羧基和羟基
D.油脂的种类很多,但它们水解后都一定有一产物相同
难度: 中等查看答案及解析
-
下列实验现象中烟雾的解释不正确的是
A B C D
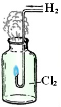
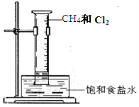

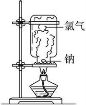
白雾:成分是盐 酸小液滴 白雾:成分是空气中的水蒸气 白烟:成分是氯化铵固体颗粒 白烟:NaCl固体颗粒
难度: 中等查看答案及解析
-
下列解释实验事实的平衡不正确的是
实 验 解释
A 100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 H2O
H+ + OH-
B 0.1 mol/L CH3COOH的pH=3 CH3COOH
CH3COO- + H+
C 配制FeCl3溶液时加少量盐酸 Fe3+ + 3OH-
Fe(OH)3
D 用稀硫酸洗涤BaSO4,沉淀损失小 BaSO4(s)
Ba2+(aq) + SO42-(aq)
难度: 中等查看答案及解析
-
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
难度: 中等查看答案及解析
-
已知:
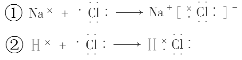
下列说法不正确的是
A.①和②变化过程中都会放出热量
B.氯原子吸引电子的能力强于钠原子和氢原子
C.①和②中的氯原子均得到1个电子达到8电子稳定结构
D.NaCl中含有离子键,HCl中含有共价键
难度: 中等查看答案及解析
-
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)= 4.0molL-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)= 1.0×10-2 molL-1
难度: 中等查看答案及解析