-
下列推断正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2
C.加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病
D.要除去衣服上的顽固污渍,均可将衣服泡在漂白液中
难度: 简单查看答案及解析
-
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是
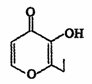
A.lmol该有机物最多能与2molH2发生加成反应
B.该有机物能发生取代、加成和氧化反应
C.该有机物的分子式为C7H6O3
D.该有机物的一种芳香族同分异构体能发生银镜反应
难度: 中等查看答案及解析
-
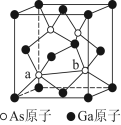
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物的碱性:X>Z
D.XR2、WR2两种化合物中R的化合价相同
难度: 中等查看答案及解析
-
为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是
A.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
B.NaBr溶液(NaI),应加入适量的氯水、CCl4,进行萃取分液
C.NH4Cl溶液(FeCl3),应加入适量的氨水,过滤
D.CO2(CO),通过过量灼热的氧化铜粉末
难度: 中等查看答案及解析
-
某温度下,碳和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)
CO(g)+H2(g),
②CO(g)+H2O(g)
CO2(g)+H2(g),
当反应达到平衡时,c(H2)=1.9mol•L-1、c(CO)=0.1mol•L-1。
则下列叙述正确的是
A.CO在平衡时转化率为10%
B.平衡浓度c(CO2)=c(H2)
C.其他条件不变时,缩小体积,反应②平衡不移动
D.平衡时增大碳的质量,反应①中热量值不变
难度: 中等查看答案及解析
-
下列说法不正确的是
A.25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
C.25℃时,某溶液中由水电离出的c(H+)=10-a mol/L,若a>7时,该溶液pH一定为14-a
D.含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
难度: 困难查看答案及解析
-
下列实验方案能达到实验目的的是
选项
实验方案
实验目的或结论
A
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
可证明氧化性:H2O2比Fe3+强
B
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀
说明Y中不含醛基
C
将一定量的NaNO3和KCl的混合液加热并
浓缩至有晶体析出时,趁热过滤
得到NaCl晶体
D
比较不同反应的反应热数据大小
从而判断反应速率的大小
难度: 中等查看答案及解析

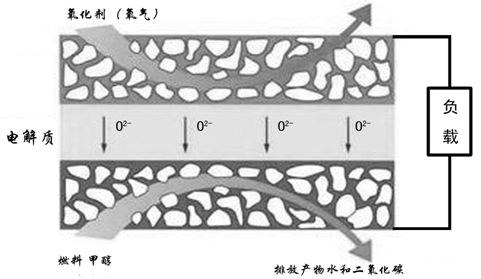
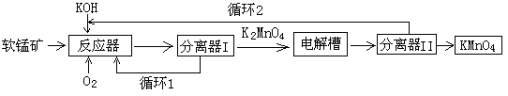
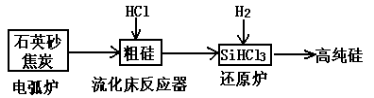
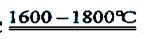 Si+2CO↑
Si+2CO↑ SiHCl3+H2
SiHCl3+H2 Si+3HCl
Si+3HCl