-
化学与我们的生活息息相关,下列变化中不包含化学变化的是:( )
A. 用石灰浆涂抹墙壁后,表面有水珠生成
B. 用镶有金刚石的玻璃刀裁玻璃
C. 在口中咀嚼米饭时感到有甜味
D. 使用液化气做燃料烧饭做菜
难度: 中等查看答案及解析
-
下列有关试剂的保存方法不正确的是( )
A. 硝酸银溶液保存在棕色试剂瓶中 B. 白磷保存在水中
C. 生石灰保存在烧杯中 D. 浓硫酸密封保存在试剂瓶中
难度: 中等查看答案及解析
-
初中阶段我们学习了,物质得氧发生氧化反应,物质失氧发生还原反应,进入高中后我们将给氧化还原反应下一个广义的定义:有元素化合价发生改变的反应都是氧化还原反应。下列判断错误的是( )
A. 置换反应都属于氧化还原反应
B. 复分解反应都不属于氧化还原反应
C. 有单质参加的化合反应属于氧化还原反应
D. 分解反应都属于氧化还原反应
难度: 中等查看答案及解析
-
冬天的教室门窗紧闭,时间长了同学们会感觉到胸闷缺氧,测定出教室中氧气的体积分数可能是( )
A. 2% B. 19% C. 25% D. 78%
难度: 中等查看答案及解析
-
分类法在科学研究中具有广泛的应用。下列说法正确的是 ( )
A. 金刚石和石墨都是由碳元素组成的单质,它们的性质都相同
B. 镁和铜均属于金属单质,它们都能与稀硫酸反应放出氢气
C. 一氧化碳和二氧化碳都属于非金属氧化物,它们都能与氢氧化钠溶液反应
D. 硫酸铵、氯化铵均属于铵盐,它们都不能跟碱性肥料混合使用
难度: 中等查看答案及解析
-
食用下列方法处理过的食品,不会危及人体健康的是( )
A. 用干冰冷藏的食品 B. 牛奶中添加氧化钙以补充钙质
C. 用甲醛浸泡的海鲜 D. 用工业用盐腌制的肉类食品
难度: 中等查看答案及解析
-
将锌粒投入下列溶液当中,一段时间后取出,溶液质量减轻的是( )
A. 稀盐酸 B. 硝酸银 C. 硫酸铜 D. 氯化亚铁
难度: 困难查看答案及解析
-
非金属元素N可以形成多种氧化物,N2O、NO2、NO、N2O3、N2O5,按氮元素在这些氧化物中的化合价由低到高的顺序排列的是( )
A. N2O、NO、NO2、N2O3、N2O5 B. N2O5、N2O3、NO2、NO、N2O
C. N2O、NO、N2O3、NO2、N2O5 D. N2O、NO2、N2O3、NO、N2O5
难度: 中等查看答案及解析
-
有一包不纯的Na2CO3样品,其中只含一种杂质,现取该样品5.3 g与足量稀盐酸反应生成2.4 g CO2,则所混杂质可能是( )
A. BaCO3 B. K2CO3 C. ZnCO3 D. MgCO3
难度: 困难查看答案及解析
-
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+2O2
CO2+2H2O,下列关于X的说法正确的是( )
A. X由碳、氢、氧三种元素组成 B. X的相对分子质量为40
C. X中碳、氢元素的质量比为3:1 D. X属于无机化合物
难度: 中等查看答案及解析
-
二氧化硫是一种有毒、易溶于水、密度比空气大的气体,且能和水发生反应生成酸,在空气中易形成酸雨。根据以上信息推断,下列收集气体的装置中,适合收集SO2的是
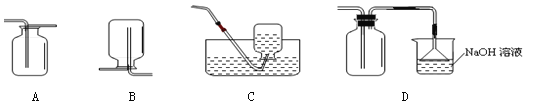
难度: 简单查看答案及解析
-
在一个密闭容器内,有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量见下表
物 质
A
B
C
D
反应前的质量(g)
4
6
111
4
反应后的质量(g)
待测
15
0
84
依据上表判断,下列说法正确的是( )
A. 该反应是化合反应 B. 待测值为22
C. 生成A和B的质量比为22:9 D. D物质是该反应的反应物
难度: 中等查看答案及解析
-
如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )

A. 将t2℃甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的选项是乙>甲>丙
B. t2℃时,将30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5%
C. 要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法
D. 将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法
难度: 中等查看答案及解析
-
某同学测得海水中含有Cl—的质量分数为2.19%,如果其中的Cl—全部以NaCl计算,则海水中所含NaCl的质量分数是 ( )
A. 2.18% B. 5.85% C. 3.61% D. 4.19%
难度: 困难查看答案及解析
-
下列四个实验中只需要完成三个就可以证明Zn、Cu、Ag三种金属的活动性顺序,其中不必进行的实验是( )
A. 将锌片放入稀硫酸 B. 将铜片放入稀硫酸
C. 将铜片放入硝酸银溶液 D. 将锌片放入硝酸银溶液
难度: 困难查看答案及解析
-
小明在实验室中找到了三包已经失落标签的白色粉末,已知是CaCO3、Na2CO3、CaO,请从下面的试剂或方法中选择一种来确定该三种物质( )
A、稀盐酸 B、水 C、加强热 D、CaCl2 溶液
难度: 困难查看答案及解析
-
除去下列物质中所含的杂质,所选用的试剂和方法不正确的是( )
选项
物质
杂质
试剂和方法
A
CO2
水蒸气
通过氢氧化钠固体
B
CuO
Cu
在空气中加热
C
KCl
MnO2
溶解、过滤、蒸发结晶
D
CaCl2溶液
盐酸
加入稍过量的CaCO3再过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成。取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液X。在滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。下列判断错误的是 ( )
A. 原白色粉末中一定不含有CuSO4
B. 原白色粉末中一定含有CaCO3
C. 原白色粉末的组成有3种可能
D. 若向无色滤液X中通入二氧化碳,产生白色沉淀,则可推断原白色粉末中一定还含有BaCl2、NaOH
难度: 困难查看答案及解析
-
向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图所示曲线表示的是( )
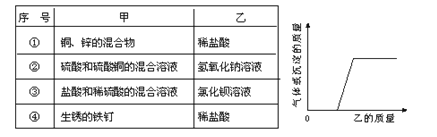
A. ①③ B. ④ C. ③④ D. ②④
难度: 中等查看答案及解析
-
下列图像能正确反映对应变化的是( )
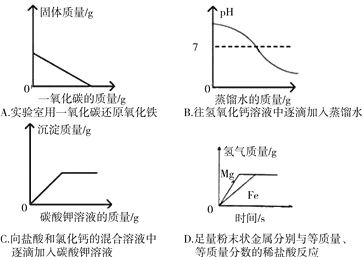
A. A B. B C. C D. D
难度: 中等查看答案及解析