-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A. C(s)+1/2 O2(g)=CO(g) △H= ―393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D. C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
难度: 中等查看答案及解析
-
在反应A
2B中,A、B的浓度变化如图所示,则2 min以内的平均反应速率为( )

A. vA=9 mol/(L·min)
B. vA=4.5 mol/(L·min)
C. vB=18 mol/(L·min)
D. vB=9 mol/(L·min)
难度: 简单查看答案及解析
-
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A. 盐酸的浓度 B. 铝条的表面积 C. 溶液的温度 D. 加少量Na2SO4
难度: 简单查看答案及解析
-
已知有热化学方程式:SO2(g)+ 1/2 O2(g)
SO3(g);△H =-98.32kJ/mol,现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于( )
A. 40% B. 50% C. 80% D. 90%
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 在热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的
B. 升高温度或加入催化剂,可以改变化学反应的反应热
C. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
D. 物质发生化学变化一定伴随着能量变化
难度: 中等查看答案及解析
-
一定质量的无水乙醇完全燃烧时放出的热量为Q,它生成的CO2用过量饱和石灰水完全吸收可得100gCaCO3沉淀。则完全燃烧1mol无水乙醇时放出的热量是( )
A. 0.5Q B. Q C. 2Q D. 5Q
难度: 中等查看答案及解析
-
可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象正确的是( )
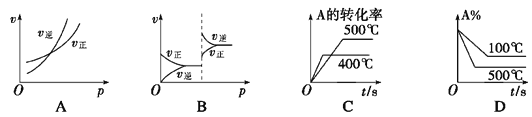
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
可逆反应:2NO2
2NO+O2 在定容密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③NO2、NO、O2 的物质的量浓度变化之比为2 : 2 : 1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥ 混合气体的平均相对分子质量不再改变
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①③④⑤
难度: 中等查看答案及解析
-
右图曲线a表示放热反应 X(g) + Y(g)
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )

A. 升高温度 B. 加大X的投入量
C. 加催化剂 D. 增大体积
难度: 简单查看答案及解析
-
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH= - 92.4 KJ/mol,则N≡N键 的 键 能是( )
A. 431 KJ/mol B. 946 KJ/mol C. 649 KJ/mol D. 869 KJ/mol
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
难度: 中等查看答案及解析
-
当把晶体N2O4放入密闭容器中气化,并建立了N2O4(g)
2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其
 值 ( )
值 ( )A. 变大 B. 不变 C. 变小 D. 无法确定
难度: 简单查看答案及解析
-
在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2(g)=CO(g) △H=-110.5kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是
A. 172.5kJ B. 1149kJ C. 283kJ D. 517.5kJ
难度: 困难查看答案及解析
-
某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )
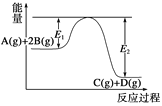
A. 该反应为吸热反应
B. 当反应达到平衡时,降低温度,A的转化率减小
C. 升高温度平衡常数K增大;压强增大,平衡向正反应方向移动
D. 加入催化剂,反应速率增大,反应热不变
难度: 简单查看答案及解析