-
下列说法中,错误的是
A.有了化学科学,人类能够更好利用能源和资源
B.化学科学将为环境问题的解决提供有力的保障
C.化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中
D.化学家可以制造出自然界中不存在的物质
难度: 简单查看答案及解析
-
下列发生在厨房中的变化与氧化还原反应无关的是
A. 食物腐败 B. 用食醋除热水瓶水垢
C. 铁的生锈 D. 液化气燃烧
难度: 简单查看答案及解析
-
下列溶液与20mL1 mol·L—1 NaNO3溶液中NO3—物质的量浓度相等的是
A.10 mL 1 mol·L—1 Mg(NO3)2溶液 B.5 mL 0.8 mol·L—1 Al(NO3)3溶液
C.10 mL 2 mol·L—1 AgNO3溶液 D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液
难度: 简单查看答案及解析
-
下列物质的分类正确的是
酸
碱
盐
氧化物
A
HClO
NH3
FeCl2
NO2
B
CH3COOH
NaOH
BaSO4
CH3CH2OH
C
H2SO4
Cu(OH)2
NH4NO3
H2O
D
HNO3
CO(NH2)2
Mg(OH)Cl
CO
难度: 简单查看答案及解析
-
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在55~36 nm的磁流体。下列说法中正确的是
A.所得的分散系属于悬浊液 B.该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3 D. 纳米材料也是一种胶体
难度: 简单查看答案及解析
-
盛有一向定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是
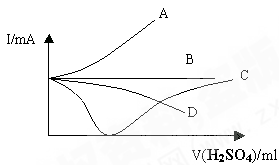
难度: 简单查看答案及解析
-
具备基本的化学实验技能是进行科学探究的基础和保证。下列有关实验操作正确的是
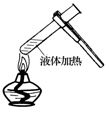
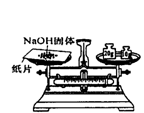
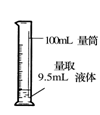
A.给液体加热 B. 转移溶液 C. 称取NaOH固体 D.量取液体
难度: 简单查看答案及解析
-
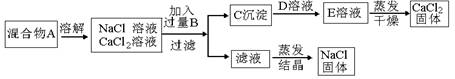
在不用指示剂的前提下,欲将含有盐酸的氯化钙溶液中的盐酸除去,最好选用下列物质中的
A.碳酸钙 B.石灰水
C.氢氧化钠 D.熟石灰
难度: 简单查看答案及解析
-
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
A.原子数 B.分子数 C.体积 D.物质的量
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,以下各说法中不正确的是
A.1mol钠作为还原剂可提供的电子数为NA
B.17g NH3中所含电子个数为10 NA
C.22.4LN2分子中所含原子数为2 NA
D.1L2mol·L-1的Mg(NO3)2溶液中含NO3-个数为4 NA
难度: 简单查看答案及解析
-
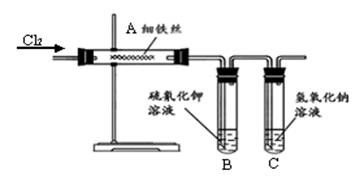
在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C.氯水滴在PH试纸上,一段时间后将观察到试纸变红,说明H+存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在
难度: 简单查看答案及解析
-
若A+酸==盐+水,则A不可能属于
A.氧化物 B.单质 C.碱 D.电解质
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.少量金属钠放入冷水中:Na + 2H2O = Na+ + 2OH- + H2↑
C.氧化铜溶于硫酸:O2―+2H+ =H2O
D.碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
难度: 简单查看答案及解析
-
下列反应中属于氧化还原反应,且水作为氧化剂的是
A.Cl2+H2O=HCl+HClO B.2Na+2H2O=2NaOH+H2↑
C.2F2+2H2O=4HF+O2 D.2Na2O2+2H2O=4NaOH+O2↑
难度: 简单查看答案及解析
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C
2AlN + 3CO 下列叙述正确的是
A. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中每生成2molAlN,N失去6mol电子
C. 氮化铝中氮元素的化合价为-3
D. 氮化铝是氧化产物
难度: 简单查看答案及解析
-
M2O7X-与S2-在酸性溶液中反应如下:M2O7X-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7X-中M的化合价是
A.+2 B.+3 C.+4 D.+6
难度: 简单查看答案及解析
-
把一定量的铁粉放入氯化铁溶液中,反应完全后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等,则已反应的Fe3+和原来总的Fe3+的物质的量之比是
A.1:1 B.2:5 C.2:3 D.3:5
难度: 简单查看答案及解析
-
下列各组离子,能在溶液中大量共存的是
A.NH4+ 、Cl—、 K+、SO42— B.Fe3+、Na+、OH—、NO3—
C.Ag+、Na+、Cl—、NO3— D.H+、Na+、NO3—、CO32—
难度: 简单查看答案及解析