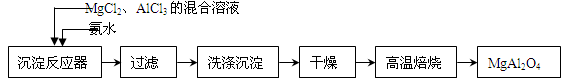
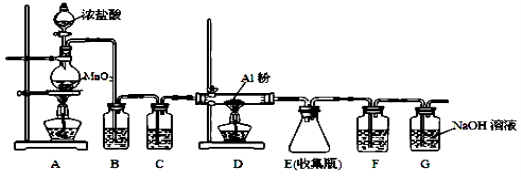
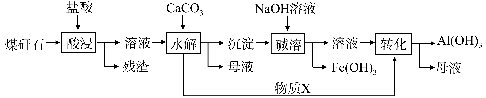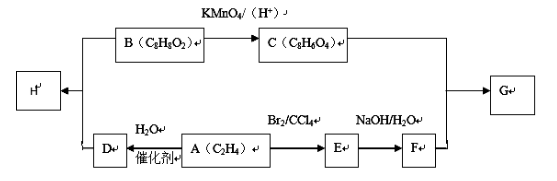-
下列实验现象与对应结论均正确的是( )
选项 操作 现象 结论
A 常温下将Cu片放入浓H2SO4中 生成刺激性气味气体 Cu与浓H2SO4反应生成SO2
B Al2(SO4)3溶液中滴加过量氢氧化钡溶液 生成白色沉淀 Al(OH)3不溶于氢氧化钡溶液
C 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 溶液先不显红色,加入氯水后变红色 该溶液中含有Fe2+
D 向某溶液中加入CCl4,振荡后静置 液体分层,下层呈紫红色 该溶液中存在I-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1L 1mol•L-1的NH4Cl溶液中一定含有NA个NH4+
B.常温常压下,22.4L乙烯中含共价键数为5 NA
C.6.8g熔融的KHSO4中含有0.05 NA个阳离子
D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下反应可生成NA个H2O
难度: 中等查看答案及解析
-
对①乙醇②淀粉③油脂④蛋白质的说法,不正确的是( )
A.等质量的②和③在人体内充分消化吸收时,③释放的能量更大
B.①能使④失去生理活性而变性
C.①可由②水解的最终产物反应制得
D.③和④在人体内的最终代谢产物相同
难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
难度: 困难查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由大到小的顺序为:Z>Y> W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2
难度: 中等查看答案及解析
-
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
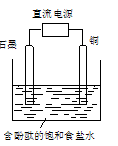
A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液呈红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)
Z(g)△H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢
难度: 中等查看答案及解析
 为提高氮氧化物的转化率可采取的措施是
为提高氮氧化物的转化率可采取的措施是