-
化学与科学、社会和人类生活密不可分,修订后的《中华人民共和国大气污染防治法》已于2016年1月1日起施行。下列有关大气污染防治说法错误的是
A.开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染
B.农作物收割后留下的秸秆可以就地焚烧
C.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境
D.汽油发动机工作时会产生少量NO和CO,采用催化反应装置可以减少污染物排放
难度: 简单查看答案及解析
-
现有五种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是
A. 原子半径:Y<Q<W
B. ZX3可使紫色石蕊溶液变蓝
C. X、Z、Q三种元素可组成离子化合物或共价化合物
D. X2Q2、Y2X6两种分子中含有的电子数相同
难度: 简单查看答案及解析
-
根据下列热化学方程式,判断氢化物的稳定性顺序正确的是
N2(g)+ 3H2 (g)=2NH3(g) ΔH=-92.4kJ·mol-1
H2(g)+ Cl2(g)=2HCl(g) ΔH=-184.6kJ·mol-1
I2(g)+ H2 (g)=2HI(g) ΔH=-9.4kJ·mol-1
A.HCl>NH3>HI
B.HI>HCl>NH3
C.HCl>HI>NH3
D.NH3>HI>HCl
难度: 简单查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. WX3和水反应形成的化合物是共价化合物
B. 单质的熔点:Y>Z
C. X、Y、R形成的某种化合物可以用于漂白、消毒
D. Y、Z和W三者最高价氧化物对应的水化物能两两相互反应
难度: 简单查看答案及解析
-
25℃、101 kPa下:①2Na(s)+1/2O2(g)=Na2O(s) 放出414 kJ的热量
②2Na(s)+O2(g)=Na2O2(s)放出511 kJ的热量,下列说法正确的是
A.①和②产物含有阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率越来越快
D.25℃、101 kPa下:Na2O2(s)+2Na(s)=2Na2O(s) 放出317 kJ的热量
难度: 简单查看答案及解析
-
下列说法正确的是
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C. 所含质子数和电子数都相同的粒子一定是分子
D. 同一元素的各种同位素的物理性质、化学性质均相同
难度: 中等查看答案及解析
-
下列变化中可以说明SO2具有漂白性的是
A.SO2通入高锰酸钾酸性溶液中紫色褪去
B.SO2通入品红溶液中红色褪去
C.SO2通入溴水溶液中红棕色褪去
D.SO2通入氢氧化钠与酚酞的混合溶液中红色褪去
难度: 中等查看答案及解析
-
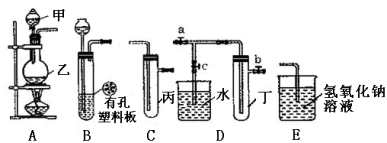
对于实验I~IV的实验现象预测正确的是

A. 实验I :逐滴滴加盐酸时,试管中立即产生大量气泡.
B. 实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C. 实验III:从饱和食盐水中提取NaCl晶体
D. 装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去]
难度: 简单查看答案及解析
-
运用元素周期律分析下面推断,其中错误的是
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸
C. 硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定
难度: 简单查看答案及解析
-
将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=1 mol·L-1·min-1。 则三个容器中合成氨的反应速率
A.v(甲)>v(乙)>v(丙)
B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)
D.v(乙)>v(甲)>v(丙)
难度: 简单查看答案及解析
-
已知2molH2完全燃烧生成水蒸气放出热量484 kJ,且1 molH—H键断裂时吸收热量为436 kJ,水蒸气中1 molH—O键形成时放出热量463 kJ,则O2中1 molO=O键完全断裂时吸收热量
A.496 kJ B.188 kJ C.557 kJ D.920kJ
难度: 简单查看答案及解析
-
对于可逆反应N2(g)+3H2 (g)
2NH3(g) △H<0,下列研究目的和示意图相符的是
A
B
C
D
研究目的
压强对反应的影响
(P2>P1)
温度对反应的
影响
平衡体系增加N2
对反应的影响
催化剂对反应的
影响
图示
难度: 困难查看答案及解析
-
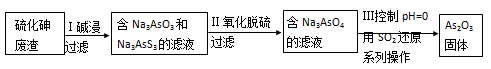
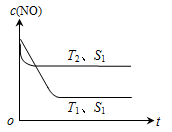
低温脱硝技术可用于处理废气中的氮氧化物, 发生的化学反应为:

在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 中等查看答案及解析
-
从海水中提取金属镁的生产步骤有:①浓缩结晶脱水 ②加熟石灰 ③加盐酸 ④过滤 ⑤熔融电解,正确的生产顺序是
A.①②③④⑤ B.⑤④③①② C.②④③①⑤ D.③④②①⑤
难度: 中等查看答案及解析
-
21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是
A.海水含镁,将金属钠放入海水中可以制取金属镁
B.从海水中提取溴的过程涉及氧化还原反应
C.利用海水制取精盐不涉及化学反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
难度: 中等查看答案及解析