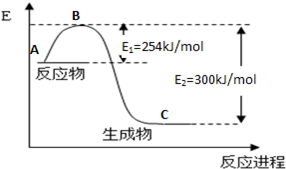
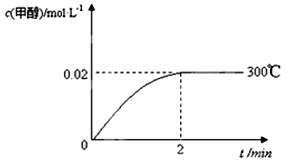
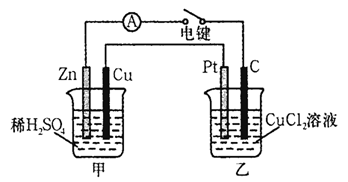
-
人类将在几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
A.煤、石油和天然气都属于碳素燃料
B.发展太阳能经济有助于减缓温室效应
C.太阳能电池可将太阳能直接转化为电能
D.目前研究菠菜蛋白质“发电”不属于太阳能文明
难度: 简单查看答案及解析
-
下列说法正确的是
A.放热反应在常温下一定很容易发生
B.决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等
C.熵增加且放热的反应一定是自发反应
D.非自发的反应即不可能进行的反应
难度: 中等查看答案及解析
-
下列措施肯定能使化学反应速率增大的是
A.增大反应物的量 B.增加压强 C.升高温度 D.使用催化剂
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / (L·s) B.υ(C)=0.5 mol / (L·s)
C.υ(B)=0.6 mol / (L·s) D.υ(A)=0.15 mol / (L·s)
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A.NaOH固体 B.少量硫酸铜固体 C.H2O D.少量NaCl固体
难度: 中等查看答案及解析
-
一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)
2B(g)+C (g),下列能说明反应已达平衡状态的是
A.混合气体的密度保持不变 B.容器内B、C的浓度之比为2∶1
C.B的生成速率等于C的消耗速率 D.气体的体积分数保持不变
难度: 中等查看答案及解析
-
已知(1) H2(g)+
O2(g)=H2O(g) ; DH1=akJ·mol-1
(2) 2H2(g)+O2(g)=2H2O(g) ; DH2=b kJ·mol-1
(3) H2(g)+
O2(g)=H2O(l) ; DH3=c kJ·mol-1
(4) 2H2(g)+O2(g)=2H2O(l) ; DH4=d kJ·mol-1
下列关系式中正确的是
A. a<c<0 B.b>d>0 C. 2a=b<0 D.2c=d>0
难度: 中等查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
A.a>c>d>b B.a>b>c>d
C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
下列说法不正确的是
A.铸铁输油管道应埋在干燥致密不透气的土壤中
B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀
C.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4OH-
D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
难度: 中等查看答案及解析
-
单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜)+O2(g)=SO2 (g) △H1=-297.16kJ·mol-1
②S(s,正交)+O2(g)=SO2 (g) △H2=-296.83kJ·mol -1
下列说法正确的是
A.S(s,单斜)=S(s,正交) △H3=+0.33kJ·mol -1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多297.16kJ
难度: 中等查看答案及解析
-
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+H2O(g)
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
A.充入氦气 B.分离除乙醇 C.增大压强 D.升高温度
难度: 中等查看答案及解析
-
可逆反应2HI(g)
H2+I2(g)在密闭容器中装入1molHI气体在一定条件下使它分解,已知有35%发生分解,则容器内混合气体的总物质的量是
A. 1mol B. 0.5mol C.1.5mol D.2mol
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e–=PbSO4
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
难度: 中等查看答案及解析
-
已知448℃时反应H2(g)+I2(g)
2HI(g)的平衡常数是49,则HI(g)
H2(g)+
I2(g) 在该温度下的平衡常数是
A.
B.2401 C.7 D.
难度: 中等查看答案及解析
-
下列关于化学能与电能相互转化的说法正确的是
A. 在原电池中,化学能转变为电能,电子沿导线由正极流向负极
B. 双液原电池通过盐桥连接,KCl盐桥中K+朝正极定向迁移
C. 在电解池中,与电源负极相连的电极称为阳极,溶液中阴离子朝阳极定向迁移
D. 电解氯化铜溶液,在阴极上产生的气体能使湿润的KI-淀粉试纸变蓝
难度: 中等查看答案及解析
-
用惰性材料作电极,分别电解下列物质,当相同电量时,下列指定的电极上析出气体质量最大的是
A.熔融的NaCl(阳极) B.NaCl溶液(阴极)
C.NaOH溶液(阴极) D.Na2SO4(阳极)
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D.实验室用排饱和食盐水而不用排水法收集氯气
难度: 中等查看答案及解析
-
化学反应C(s)+H2O(g)
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.加入固体碳,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡向逆反应方向移动动
D.减小压强,平衡向正反应方向移
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.化学计量数关系:a>b
难度: 中等查看答案及解析
-
下列说法正确的是
A.蓄电池充电时其负极应与外电源的的正极相连接
B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同
C.已知:H2(g)+I2(g)
2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量
D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是

A.反应的化学方程式为:X(g)+Y(g)
Z(g)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
难度: 中等查看答案及解析
-
下列图像能正确地表达可逆反应3A(g)+B(g)
2C(g)(△H<0)的是

难度: 困难查看答案及解析
-
爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH-
③ 放电时,电解质溶液中的阴离子向负极方向移动
④ 放电时,负极上的电极反应式为:Fe+2H2O-2e-=Fe(OH)2+2H+
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.③ B.③④ C.④ D.①②⑤
难度: 中等查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
容器编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
难度: 困难查看答案及解析