-
下列叙述中正确的是( )
A. 氯化钠中混有少量单质碘杂质,可用升华的方法提纯
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. SO2可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性
D. 浓硫酸具有吸水性,可以用作干燥剂,例如可用于NH3的干燥
难度: 中等查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A. Fe2(SO4)3 B. KNO3 C. FeSO4 D. Na2CO3
难度: 中等查看答案及解析
-
雾霾严重地威胁着人们生命生存的生态环境。下列有关措施不可行的是( )
A. 对燃煤进行脱硫,减少向大气排放SO2
B. 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
C. 为增加工业产值,大力兴建水泥厂、炼钢厂
D. 对汽车等交通工具采用清洁燃料,如天然气、甲醇等
难度: 中等查看答案及解析
-
分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )
A. 根据是否含有氧元素,将物质分为氧化剂和还原剂
B. 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
C. 根据水溶液是否能够导电,将物质分为电解质和非电解质
D. 根据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
难度: 中等查看答案及解析
-
下列基础概念叙述正确的是( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变成游离态时,该元素一定被还原
D. 金属阳离子被还原一定得到金属单质
难度: 中等查看答案及解析
-
化学试剂不变质和实验方法科学是化学实验成功的保障。下列试剂保存方法或实验方法中,不正确的是( )
A. 实验室中金属钠通常保存在煤油里
B. 液溴易挥发,在存放液溴的试剂瓶中应加水封
C. 保存FeCl3溶液时,通常在溶液中加少量的单质铁
D. 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是( )
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 向碘水中滴CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与盐酸反应时失去的电子数目为0.3 NA
B. 71 g氯气所含原子数目为NA
C. 标准状况下,以任意比混合的氮气和氧气11.2 L,所含的分子数为0.5 NA
D. 在25℃,1.01×105 Pa时,22.4 L氢气所含的原子数目为2 NA
难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是( )
A. 分离碘和酒精
B. 除去CO2中的HCl

C. 实验室制氨气
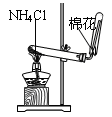 D. 排水法收集NO
D. 排水法收集NO 难度: 中等查看答案及解析
-
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成2 mol AlN需转移6 mol电子
C. AlN中氮元素的化合价为+3
D. AlN的摩尔质量为41 g
难度: 中等查看答案及解析
-
已知有如下反应:①2BrO
+ Cl2 = Br2 + 2ClO
,②ClO
+ 5Cl- + 6H+ = 3Cl2 + 3H2O,③2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2,④2FeCl2 + Cl2 = 2FeCl3 。
下列各微粒氧化能力由强到弱的顺序正确的是( )
A. ClO
> BrO
> Cl2 > Fe3+ > I2 B. BrO
> Cl2 > ClO
> I2 > Fe3+
C. BrO
> ClO
> Cl2 > Fe3+ > I2 D. BrO
> ClO
> Fe3+ > Cl2 > I2
难度: 中等查看答案及解析
-
下列离子方程式,书写不正确的是( )
A. 大理石与盐酸反应 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
B. 氯化铁溶液中插入铜片:2Fe3++Cu══2Fe2++Cu2+
C. 碳酸氢钠溶液与氢氧化钠反应: OH-+HCO
══CO32-+H2O
D. 将铁片放入硫酸铁溶液中:Fe + Fe3+ ==2Fe2+
难度: 中等查看答案及解析
-
一定能在下列溶液中大量共存的离子组是( )
A. 含有大量Mg2+的溶液:Na+、NH4+、SO
-、Cl-
B. 碱性溶液:Na+、Ca2+、SO
-、CO
-
C. 含有大量Fe3+的溶液:Na+、Mg2+、NO
、SCN-
D. 含有大量NO
的溶液:H+、Fe2+、SO
-、Cl-
难度: 中等查看答案及解析
-
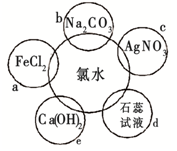
下列溶液中能用来区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③酸性KMnO4 ④氯水 ⑤品红溶液 ⑥紫色石蕊试液
A. ①②③⑤ B. ①⑥ C. ① D. ②③④⑤
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解
该溶液中一定含有SO42-
B
向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体
该溶液中一定含有CO32-
D
向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体
该溶液中一定含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
24mL浓度为0.05mol·L-1 Na2SO3 溶液恰好与20mL 浓度为0.02mol·L-1 的K2X2O7 溶液完全反应,已知Na2SO3 可被K2X2O7 氧化为Na2SO4 ,则元素X 在还原产物中的化合价为( )
A. +2 价 B. +3 价 C. +4价 D. +5价
难度: 困难查看答案及解析