-
常温下,将0.01mol NH4Cl和 0.002mol NaOH 溶于水配成1L 混合溶液,
(1)该溶液中存在的三个平衡体系是:________、________、________.
(2)溶液中共有________种不同的粒子.
(3)这些粒子中浓度为0.01mol/L 的是________,浓度为0.002mol/L 的是________.
(4)物质的量之和为0.01mol的两种粒子是:________.
(5)________和________ 两种离子数量之和比OH-多0.008mol.难度: 中等查看答案及解析
-
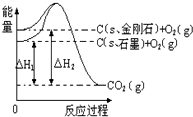
(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为________.
(2)下表中的数据表示破坏1mol化学键需消耗的能量:根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=________.
(3)发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:化学键 C-H C-F H-F F-F 键能 414 489 565 158
N2 (g)+2O2 (g)=2NO2 (g)△H1=+67.7kJ•mol-1;
2H2 (g)+O2 (g)=2H2O(g)△H2=-484kJ•mol-1;
N2H4 (g)+O2 (g)=N2 (g)+2H2O(g)△H3=-534kJ•mol-1;
H2O(1)=H2O(g)△H5=+44.0kJ•mol-1.
写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式:________
(4)下列说法正确的是(填序号)________:
A.同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.对于Al(OH)3(s)⇌Al(OH)3(aq)⇌Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大.难度: 中等查看答案及解析
-
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I.属于非电解质的是________;(填序号)
Ⅱ.(1)NaHCO3是一种________(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:________;
(3)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH -五种微粒的浓度由大到小的顺序为:________.
Ⅲ.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为________;
(2)溶液中由水电离出c(OH -)=________;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=________.
Ⅳ.醋酸是一种弱电解质. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.则图________(填“I”或“Ⅱ”)为醋酸稀释的图象.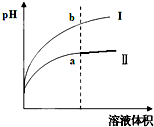
难度: 中等查看答案及解析
-
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
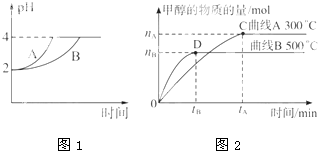
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________(填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1________m2.(选填”<“、”=“或”>“)
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g).该反应的平衡常数表达式K=________,升高温度,K值________(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________.
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)⇌Mg2+ (aq)+2OH- (aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol•L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;该温度下,在0.20L的0.002mol•L-1MgSO4溶液中加入等体积的0.10mol•L-1的氨水溶液,该温度下电离常数K,经计算________(填”有”或”无”)Mg(OH)2沉淀生成.
(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈________性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).
难度: 中等查看答案及解析