-
下列说法正确的是( )
A.需要持续不断加热才能发生的反应一般为吸热反应
B.放热反应在常温下一定很容易发生
C.反应热(△H)=反应物的总能量-生成物的总能量
D.吸热反应任何条件下都不能发生难度: 中等查看答案及解析
-
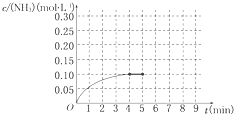
在四个相同的容器中,不同的温度下(其它条件相同)进行合成氨的反应,根据下列在相同时刻测得的结果判断,该反应所处的温度最高的是( )
A.v(NH3)=0.4 mol/
B.v (H2)=0.6 mol/
C.v (N2)=0.3 mol/
D.v (NH3)=0.02 mol/难度: 中等查看答案及解析
-
在水溶液中进行的反应:3KSCN+FeCl3⇌Fe(SCN)3+3KCl,当达到平衡时,(从离子方程式的角度回答)下列说法错误的是( )
A.加入一定量的铁粉,充分振荡后,溶液颜色变浅
B.加入一定量的NaOH溶液,有红褐色沉淀产生,溶液颜色变浅
C.加入少量的KCl固体,平衡左移,溶液颜色变浅
D.加水稀释,平衡左移,溶液颜色变浅难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.某反应的平衡常数仅是温度的函数,其数值大小与该反应的焓变(△H)无关
B.催化剂不能改变平衡常数的大小,平衡常数越大,反应一定越容易进行
C.对于一个处于平衡状态的化学反应来说,平衡常数发生变化,化学平衡不一定发生移动
D.化学平衡发生移动,平衡常数不一定发生变化难度: 中等查看答案及解析
-
已知反应CO(g)=C(s)+1/2O2(g)的△H>0.设△H和△S都不随温度而变,下列说法中正确的是( )
A.任何温度下都是非自发变化
B.高温下是自发变化
C.任何温度下都是自发变化
D.低温下是自发变化难度: 中等查看答案及解析
-
下列各电离方程式中书写正确的是( )
A.
B.
C.H2CO3⇌2H++CO
D.难度: 中等查看答案及解析
-
在NH3.H2O⇌NH
+OH-形成的平衡中,要使NH3•H2O的电离程度及c(OH-)都增大,可采取的措施是( )
A.通入HCl
B.加少量NaOH固体
C.加少量氯化铵固体
D.加热难度: 中等查看答案及解析
-
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
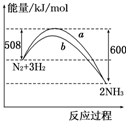
A.该反应的热化学方程式为:N2+3H2⇌2NH3 △H=-92 kJ/mol
B.b曲线是加入催化剂时的能量变化曲线
C.升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2充分反应后放出的热量为92 kJ难度: 中等查看答案及解析
-
将5.0mol PCl3和2.5mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)⇌PCl5(g),达到平衡时,PCl5为1mol,如果此时移走2.0mol PCl3和1.0mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.<0.6 mol
B.0.6 mol
C.>0.6 mol
D.无法确定难度: 中等查看答案及解析
-
一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)⇌2C(g)达到平衡标志的是( )
①恒压容器中,混合气体的密度保持不变;
②单位时间内生成a mol A,同时消耗2a mol C
③A、B、C的浓度不再变化;
④C的物质的量不再变化
⑤恒容容器中,混合气体的总压强不再变化;
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B;
⑧A、B、C的分子数之比为1:3:2.
A.②⑧
B.①②⑧
C.①②③
D.①⑤⑥难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol,Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g);△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是( )
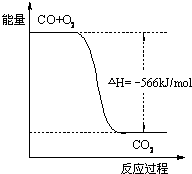
A.CO的燃烧热为283 kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);△H>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023难度: 中等查看答案及解析
-
现有下列四个图象,下列反应中全部符合上述图象的反应是( )

A.N2(g)+3H2(g)⇌2NH3(g);△H<0
B.2SO3(g)⇌2SO2(g)+O2(g);△H>0
C.4NH3(g)+5O2(g)⇌4NO+6H2O(g);△H<0
D.H2(g)+CO(g)⇌C(s)+H2O(g);△H>0难度: 中等查看答案及解析
-
在相同温度和压强下,对反应CO2(g)+H2(g)⇌CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表:
上述四种情况达到平衡后,n(CO)的大小顺序是( )CO2 H2 CO H2O 甲 a mol a mol 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol a mol
A.丁>乙>丙=甲
B.乙>丁>甲>丙
C.乙=丁>丙=甲
D.丁>丙>乙>甲难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:
从以上表格中判断以下说明不正确的是( )酸 HClO4 H2SO4 HCl HNO3 Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
A.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)⇌bB(g)达到平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.6倍,则( )
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.物质B的质量分数减小了
D.a>b难度: 中等查看答案及解析
-
在一固定容积的密闭容器中,充入3mol A 和1mol B,发生反应:3A(g)+B(g)⇌xC(g),达平衡后,C的浓度为a mol/L,若维持容器体积和温度不变,以0.6mol A、0.2mol B和1.6mol C为起始物质,达到平衡后,C的浓度也为a mol/L,则x的值为( )
A.1
B.2
C.3
D.4难度: 中等查看答案及解析