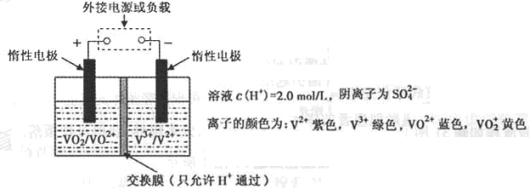
-
下列制作铅笔的材料与相应工业不对应的是
A.橡皮擦——橡胶工业
B.铝合金片——冶金工业
C.铅笔芯——电镀工业
D.铅笔漆 —— 涂料工业
难度: 简单查看答案及解析
-
己知丙烷的燃烧热△H= -2215kJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为
A. 55 kJ B.220kJ C.550 kJ D.1108 kJ
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示(质子交换膜只允许H+通过)。下列有关微生物电池的说法错误的是
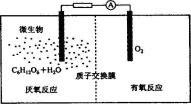
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
用图所示装置除去含CN—、Cl—废水中的CN—时,控制溶液pH为9~10,阳极产生的ClO—将CN—氧化为两种无污染的气体,下列说法不正确的是
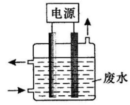
A.用石墨作阳极,铁作阴极
B.阳极的反应式为:Cl-+2OH- -2e-=ClO-+H2O
C.阴极的反应式为:2H2O+2e-=H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
难度: 中等查看答案及解析
-
下列有关金属防护的说法不正确的是
A.通过镶嵌锌块保护船体的方法叫牺牲阳极的阴极保护法
B.埋铁制管线时应选择致密、干燥的土壤层
C.青铜器表面覆盖防渗高分子膜,可防止铜绿形成
D.纯银器表面在空气中因电化学腐蚀渐渐变暗
难度: 中等查看答案及解析
-
已知A(g)+3B(g)=2C(g)+2D(g),若反应速率分别用ν(A)、ν(B)、ν(C)、ν(D)表示,下列反应速率中最快的是
A.ν(A)= 0.15mol·L-1·s-1
B.ν(B)= 0.60mol·L-1·s-1
C.ν(C)= 0.40 mol·L-1·s-1
D.ν(D)= 0.45mol·L-1·s-1
难度: 中等查看答案及解析
-
下列说法中,错误的是
A.反应的平衡转化率能表示在一定温度和一定起始浓度下反应进行的限度
B.金属在发生电化学腐蚀的过程中,总是作为原电池负极的金属被氧化而腐蚀
C.如果某化学反应的△H和△S均小于0,则反应一定能自发进行
D.SO2催化氧化时,加入过量O2时可提高SO2的转化率
难度: 中等查看答案及解析
-
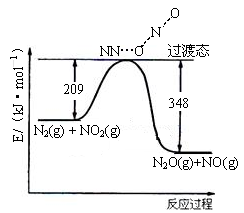
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是

A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式: H2O2 = H2O + 1/2O2 △H<0
D.反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
下列鉴别方法不可行的是
A.用水鉴别乙醇、乙酸
B.用燃烧法鉴别乙醇和四氯化碳
C.用碳酸钠溶液鉴别乙醇、甲苯
D.用酸性高锰酸钾溶液鉴别苯、环已烯
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2加压后颜色先变深后略变浅
B.在H2O2溶液中加入MnO2后产生气泡的速率加快
C.合成氨时及时将氨从反应体系中分离出去,可提高原料的利用率
D.打开汽水瓶,看到大量的气泡逸出
难度: 中等查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g) + m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 中等查看答案及解析
-
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具备输氧能力。CO吸入肺中发生反应:CO + HbO2
HbCO + O2,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
A.平衡常数K = c(O2)×c(HbCO)/[c(CO)×c(HbO2)]
B.吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比≥0.02时,人的智力才会受损
D.抢救时应把CO中毒的病人放入高压氧仓中
难度: 中等查看答案及解析
-
臭氧具有优异的杀菌、消毒功能。许多臭氧消毒柜通过电击空气中的氧气生成臭氧,在该过程中,电的作用是
A.氧化 B.还原 C.催化 D.提供能量
难度: 简单查看答案及解析
-
下列关于强、弱电解质的叙述中,错误的是
A.弱电解质在溶液中的电离过程一定是可逆过程
B.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
C.强电解质都属于离子化合物
D.强电解质在熔融状态时,有的能导电,有的不能导电
难度: 中等查看答案及解析
-
准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 中等查看答案及解析
-
下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是
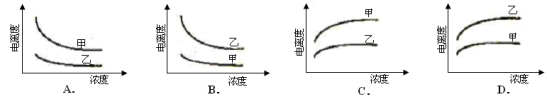
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.常温下pH=12的烧碱和pH=2的某酸溶液等体积混合,混合液的pH≤7
B.pH相同的氨水和烧碱溶液稀释相同倍数时,氨水的pH变化大
C.用同浓度盐酸中和pH相同的等体积氨水和烧碱溶液,所需盐酸体积相同
D.一定温度下,纯水中通入少量HCl气体后,KW值增大
难度: 中等查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如下右图所示。下列说法正确的是

A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
难度: 中等查看答案及解析
-
用惰性电极电解饱和NaCl溶液。下列有关的说法中,正确的是
A.在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近滴入KI溶液,溶液呈棕色
C.用阳离子交换膜电解,可防止C12进入阳极室
D.,将电解后的溶液转移到烧杯中,搅拌后溶液呈中性
难度: 中等查看答案及解析
-
室温下,pH和体积都相同的盐酸和硫酸,分别跟足量的碳酸钠溶液反应,放出CO2是
A.一样多 B.盐酸多 C.硫酸多 D.无法比较
难度: 中等查看答案及解析
-
下列溶液呈碱性,且水的电离增大的是
A.AlCl3 B. NH3·H2O C.NaHCO3 D.NaCl
难度: 中等查看答案及解析
-
NH4Cl溶液中存在NH4++ 2H2O
NH3·H2O + H3O+,向溶液中加入下列物质后,平衡逆向移动的是
A.加少量NaOH固体 B.通少量NH3
C.加入少量NH4Cl固体 D.加少量AgNO3固体
难度: 中等查看答案及解析
-
将0.20mol·L—1HCN溶液和0.10mol·L—1NaOH溶液等体积混合后,溶液显碱性。下列关系正确的是
A.c(HCN)<c(CN—) B.c(Na+)>c(CN—)
C.c(HCN)-c(CN—)= c(OH—)-c(H+) D. c(HCN)+ c(CN—)=0.20mol·L—1
难度: 中等查看答案及解析
-
下列说法中正确的是
A.
在核磁共振氢谱中有7个吸收峰
B.红外光谱图只能确定有机物中所含官能团的种类和数目
C.质谱法不能用于分子量的测定
D.核磁共振氢谱、红外光谱和质谱都可用于分析有机物结构
难度: 中等查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
难度: 中等查看答案及解析
-
下列化合物的分子中,所有原子都处于同一平面的有
A.乙烷 B.甲苯 C.氟苯 D.丙炔
难度: 中等查看答案及解析
-
分子式为C4H10O并能与金属钠反应放出氢气的有机物有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 困难查看答案及解析
-
某次酸雨的分析数据如下:c(NH4+)=2.0×10—5 mol·L—1,c(Cl —)=6.0×10—5 mol·L—1,c(Na+)= 1.9×10—5 mol·L—1,c(NO3—)=2.3×10—5 mol·L—1,c(SO42—)=2.5×10—5 mol·L—1,则此次酸雨的pH大约为
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析
-
根据有机化合物的命名原则,下列命名正确的是
A.
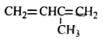 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯B.
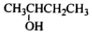 2-羟基丁烷
2-羟基丁烷C.
2-乙基戊烷
D.
3-氨基丁酸
难度: 中等查看答案及解析
-
有8种物质:①乙烷、②乙烯、③乙炔、④苯、⑤甲苯、⑥溴乙烷、⑦聚乙烯、⑧丁二烯,其中既不能使KMnO4溶液褪色,也不能与溴水发生化学反应的是
A. ①②③⑤ B.④⑥⑦⑧ C.①④⑥⑦ D.②③⑤⑧
难度: 中等查看答案及解析
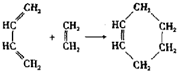 (也可表示为:
(也可表示为: