-
下列说法正确的是( )
A. 2015年8月12日,天津滨海新区某公司的仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠、电石和金属钠等危险化学品这四种药品均属于电解质
B. 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
C. 氮氧化物对环境有很大危害,如破坏臭氧层,形成酸雨,产生光化学烟雾等
D. 工业上利用氯气与澄清石灰水反应制取漂白粉
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 已知N2(g)+3H2(g)
2NH3(g) △H=-92.4 kJ·mol-1,当在一定温度压强下向一密闭容器中充入0.5molN2、1.5molH2使其充分反应,其反应放出的热量为46.2 kJ
B. 常温常压下,7.1gCl2与足量铁充分反应,转移的电子数为0.2NA
C. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
D. 12g金刚石晶体中含有的碳碳键数目为4NA
难度: 简单查看答案及解析
-
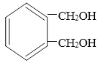
有机物A是农药生产中的一种中间体,结构简式为
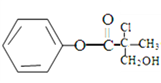 ,下列叙述中正确的是( )
,下列叙述中正确的是( )A. 1molA最多能与4mol H2发生加成反应
B. 1mol A与足量的NaOH溶液反应,消耗NaOH的物质的量为2mol
C. 有机物A与浓硫酸混合加热,可以发生消去反应
D. 有机物A可以在一定条件下与HBr发生反应
难度: 简单查看答案及解析
-
下表中的实验操作能达到实验目的的是( )
选项
实验操作
实验目的
A
向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液
检验H2O2的氧化性大于Fe3+
B
同温下用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
证明HClO和CH3COOH的酸性强弱
C
先滴入Ba(NO3)2溶液,产生沉淀,再加入足量稀盐酸,仍有沉淀
检验溶液中是否含有SO42-
D
某卤代烃与氢氧化钠溶液共热一会儿,冷却到室温,加入硝酸银溶液
测定卤代烃中卤原子的种类
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
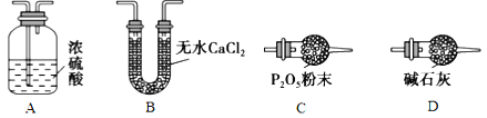
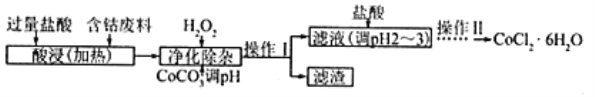
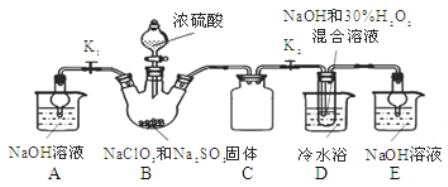
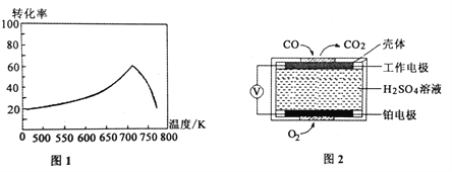
下列实验装置进行相应实验,设计正确且能达到实验目的的是
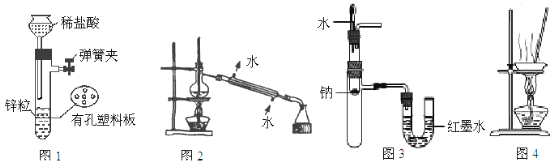
A. 用图1所示装置制取少量H2
B. 用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C. 用图3所示装置验证Na和水反应的热效应
D. 用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 简单查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
A. X、Z、W三元素形成的化合物为共价化合物
B. 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
C. 化合物YW2、ZW2都是酸性氧化物
D. 用M单质作阳极,石墨作阴极电解NaHCO3溶液,在阳极区出现白色沉淀
难度: 简单查看答案及解析
-
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )
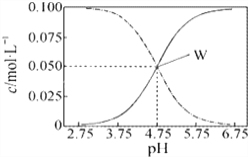
A. 25℃时,醋酸的电离常数Ka=1×10-4.75
B. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
D. W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
难度: 简单查看答案及解析



 互为同分异构体的结构简式
互为同分异构体的结构简式