-
化学与生活、科技关系密切。下列说法正确的是
A. 液氨可用作制冷剂是因为其气化时可放出大量的热
B. 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素
C. 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属
D. 久置的漂白粉变质是因为漂白粉与空气中的O2反应
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是
A. 30gNO和30gSiO2中含有的氧原子数均为NA
B. 0.5L2.0mol·L-1NaHSO3溶液中含有的HSO3-数目为NA
C. 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA
D. 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA
难度: 中等查看答案及解析
-
甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精。下列有关该有机物的叙述正确的是
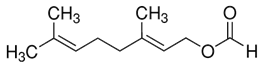
A. 分子式为C11H18O2 B. 含有羧基和碳碳双键两种官能团
C. 能发生加成反应和水解反应 D. 23gNa与过量的该物质反应生成标准状况下11.2L气体
难度: 中等查看答案及解析
-
下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项
实验
现象
结论
A
向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸
有气泡生成
常温下,铜与稀硫酸反应生成SO2
B
在酒精灯上加热铝箔
铝熔化,但熔化的铝不滴落
Al2O3的熔点比Al高
C
向Fe(SCN)3溶液中滴加稀NaOH溶液
溶液有红色变为红褐色
减小反应物浓度、平衡向逆反应方向移动
D
选用酚酞作试剂,用NaOH溶液滴定醋酸溶液
溶液变为粉红色
NaOH溶液过量
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景。如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料。下列有关该镁燃料电池的叙述正确的是
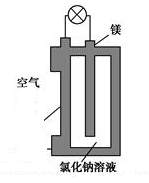
A. 该电池的总反应为2Mg+O2=2MgO
B. 反应生成O2-,该离子有正极移向负极
C. Cl-在阳极失去电子生成Cl2
D. 正极反应式为O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
硫酸锶(SrSO4)可用于烟火和陶瓷工业,该物质是矿物天青石的主要成分,可有Na2SO4溶液加入锶盐溶液沉淀而得。如图是硫酸锶的溶解曲线,下列说法正确的是
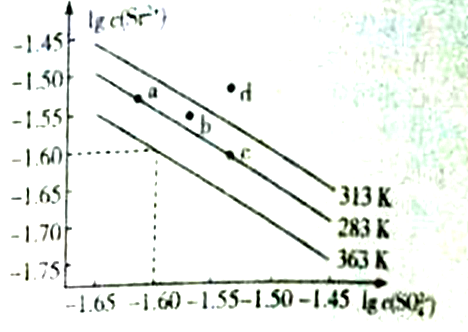
A. 图像中a、c两点的溶度积:Ksp(a)<Ksp(c)
B. 363K时的溶度积Ksp(SrSO4)=1.0×10-3.20
C. SrSO4的溶解度随温度升高而增大
D. 313K时,b点为饱和溶液,d点为不饱和溶液
难度: 中等查看答案及解析
-
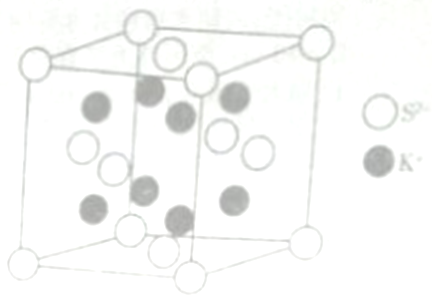
W、X、Y、Z均为短周期主族元素,且原子序数依次增大。已知W元素的原子形成的离子是一个质子;X、Y在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Z为同周期中原子半径最大的元素。下列有关说法正确的是
A. 四种元素均为非金属元素
B. W与X、Y形成的最简单分子的沸点:X>Y
C. Y、Z形成的化合物中只含离子键
D. W、Y、Z形成的化合物的电子式为
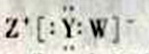
难度: 中等查看答案及解析
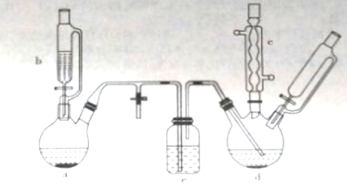

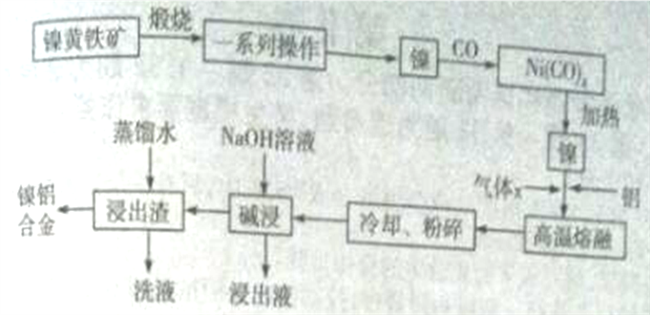
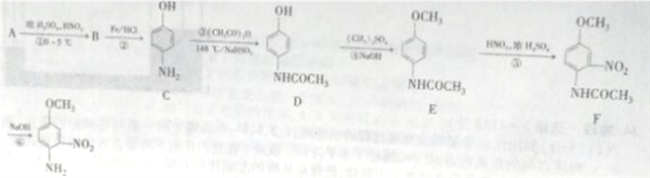
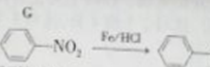 NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)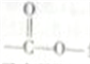 结构且能发生银镜反应
结构且能发生银镜反应