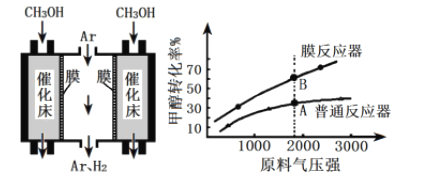
-
下列有关实验操作、实验现象和所得结论均正确的是
实验操作
实验观象
结论
A
往淀粉水解后的溶液中加入足量新制氢氧化铜并加热
有砖红色沉淀生成
淀粉完全水解
B
用0.100mol·L-1盐酸滴定未知浓度NaOH 溶液(甲基橙做指示剂)
溶液由橙色变红色,且在半分钟内不恢复
滴定到达终点
C
将BaCl2溶液滴入某溶液
生成白色沉淀
该溶液一定存在SO42-
D
往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液
红色煺去
证明CO32-水解呈碱性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
明崇祯年间《徐光启手迹》记载:“绿矾五斤,硝(硝酸钾)五斤,将矾炒去,约折五分之一,将二味同研细,次用铁作锅,……锅下起火,取气冷定,开坛则药化为强水。五金入强水皆化、惟黄金不化强水中,加盐则化。”以下说法不正确的是
A. “强 水”主 要 成 分 是 硝酸
B. “将矾炒去,约折五分之一”是指绿矾脱水
C. “锅下起火,取气冷定”描述了蒸馏的过程
D. “五金入强水皆化”过程产生的气体都是H2
难度: 简单查看答案及解析
-
下列事实不能说明氯的非金属性强于硫的是
A. 酸性:HClO3 >H2SO3 B. 稳定性:HCl>H2S
C. 3Cl2+2Fe
2FeCl3和S+Fe
FeS D. Cl2+H2S=S↓+2HC1
难度: 中等查看答案及解析
-
下列有关叙述或判断错误的是
A. Ca(ClO)2可用作饮用水的消毒剂
B. BaCO3可用作肠胃检查的内服剂
C. 锅炉中的CaSO4水垢可用Na2CO3溶液处理,再用酸除去
D. ZnCl2 浓溶液可用于去除待焊金属表面的氧化物
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 石油裂解可制取乙烯、丙烯 B. 以淀粉为原料可制取乙酸乙酯
C. 植物油氢化过程中发生了加成反应 D. 煤经过气化和液化等物理变化可以转化为清洁燃料
难度: 简单查看答案及解析
-
下列有关物质分类的说法正确的是
A. 胶体与溶液的本质区别是分散质粒子直径的大小
B. SiO2既能与NaOH 溶液反应,又能与氢氟酸反应,是一种两性氧化物
C. CO2 的水溶液可以导电,所以CO2 是电解质
D. H2SO4、NaOH、K2CO3 在水溶液中均能电离,它们均为离子化合物
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A. 1.6 gO2 和O3 的混合物含有的分子数目为0.1NA
B. 足量的Mg 与0.1mol CO2 充分反应,转移的电子数目为0.4 NA
C. 25℃时,pH=2 的H2SO3 溶液中含有的H+数目为0.02 NA
D. 标准状况下,1.12 L 三氯甲烷(CHCl3)含有的化学键数目为0.2 NA
难度: 中等查看答案及解析
-
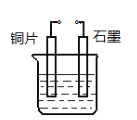
下列制取Cl2、探究其漂白性,收集并进行尾气处理的原理和装置合理的是
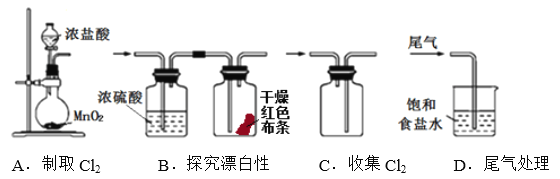
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列叙述不正确的是
A. 欲实现铁上镀锌,用锌作阴极
B. 电解精炼铜,若转移2mol电子,阴极质量增加64g
C. 硫酸工业中采用沸腾炉以增大固气接触面积,加快反应速率
D. 镁的提取工业中,MgCl2·H2O在HCl气流中脱水以防止MgCl2水解
难度: 中等查看答案及解析
-
阿司匹林是一种常见的解热镇痛药,其结构如图。下列说法不正确的是
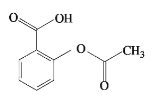
A. 分子式C9H8O4 B. 苯环上的一氯代物有4 种
C. 一定共平面的原子有8 个 D. 可以发生取代、加成、氧化反应
难度: 中等查看答案及解析
-
在溶液中加入过量Na2O2 后仍能大量共存的是
A. NH4+、Ba2+.Cl-、NO3- B. K+、SiO32-、AlO2-、SO42-
C. Fe2+、Mg2+、SCN-、Cl- D. Na+、HCO3-、SO32-、I-
难度: 中等查看答案及解析
-
锂空气电池是一种新型的二次电池,其放电时的工作原理如下图所示。下列说法正确的是

A. 电解液中,Li+由多孔电极迁移向锂电极
B. 该电池放电时,负极发生了还原反应
C. 充电时,电池正极的反应式为Li2O2=2Li++O2↑+2e-
D. 电池中的电解液可以是有机电解液或稀盐酸等
难度: 中等查看答案及解析
-
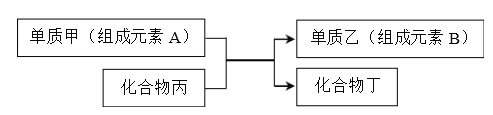
甲、乙、丙三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质转化,不能满足此关系的是
甲
乙
丙
A
NaOH
Na2CO3
NaHCO3
B
AlCl3
Al(OH)3
NaAlO2
C
NH3
N2
HNO3
D
S
SO2
H2SO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
食盐加碘是往食盐中加入微量KIO3。工业中往KOH 和KI 混合溶液中通入Cl2制取KIO3,以下说法不正确的是
A. 该条件下氧化性:Cl2> KIO3
B. 反应产物中含有KCl
C. 制取KIO3的反应中消耗KOH 和KI 的物质的量比是1:6
D. 取少量反应后混合液,加足量稀HNO3,再滴加AgNO3溶液,若无黄色沉淀,则反应已完全
难度: 中等查看答案及解析
-
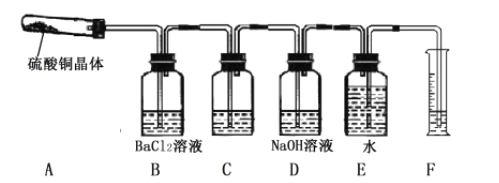
以下是以空气、海水中的物质为原料制取纯碱的工业流程:
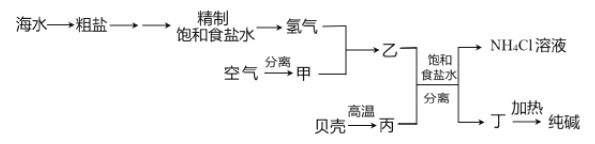
已知粗盐中含有Ca2+、Mg2+、SO42-等杂质离子。下列有关说法不正确的是
A. 除去粗盐中的杂质离子可依次加入NaOH 溶液、BaCl2 溶液、Na2CO3 溶液
B. 甲、丙分别为N2、CO2
C. 分离得到丁和NH4Cl 溶液的操作是过滤
D. 上述流程中物质转化有涉及置换反应
难度: 中等查看答案及解析
-
常温下,用某浓度的NaOH溶液滴定20.00 mL 等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
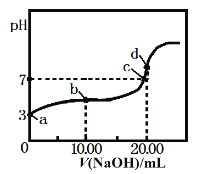
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b 两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加,W、X、Y、Z组成的单质可发生如下图所示的化学反应。B是生活中最常见的液体,Y、Z组成的化合物的水溶液呈中性。下列说法错误的是

A. 离子半径:Z>Y
B. A 与B的反应一定是化合反应
C. Y、Z二者的最高价氧化物的水化物能发生反应
D. 将等物质的量的A、C同时溶于水中,所得溶液的pH>7
难度: 中等查看答案及解析
-
已知某酸H2B 在水溶液中存在下列关系:H2B=H++HB-,HB-
H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
A. 电离方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或碱性
C. NaHB 和NaOH 溶液反应的离子方程式:HB-+OH-= H2O+B2-
D. 该溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
难度: 中等查看答案及解析