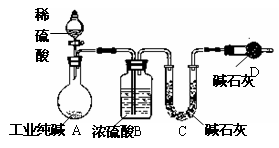
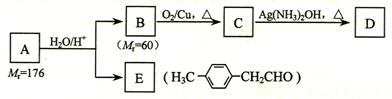
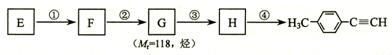
-
世界气候大会于2009年12月在丹麦首都哥本哈根召开。会议的主题是“促进低碳经济,减少CO2的排放”。下列行为中不符合这一主题的是
A.开发新能源,如太阳能、风能等,减少对化石能源的依赖
B.限制化工发展,关停化工企业,消除污染源头
C.加快研发利用二氧化碳合成聚碳酸酯类可降解塑料
D.推广煤的气化、液化技术,提供清洁燃料和化工原料
难度: 简单查看答案及解析
-
化学已渗透到人类生活的各个方面。下列说法不正确的是
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
难度: 简单查看答案及解析
-
下列说法中不正确的是
A.乙烯、乙炔和氮分子中都既含有
键又含有
键
B.分子间作用力与氢键可同时存在于不同的分子之间
C.金属元素和非金属元素的原子之间也能直接形成共价键
D.NH3、H2O2、CCl4和苯分子中的共价键全部都是极性键
难度: 简单查看答案及解析
-
在溶液中能大量共存的一组微粒是( )
A.NH+4、H+、NO-3、HCO-3 B.K+、Cu2+、SO2-4、NH3·H2O
C.Ca2+、K+、SiO2-3、OH- D.Na+、CH3COO-、CO2-3、OH-
难度: 简单查看答案及解析
-
下列操作或仪器的选用正确的是( )
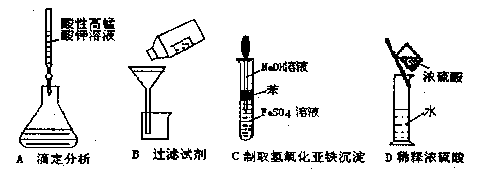
难度: 简单查看答案及解析
-
若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是
A.该元素原子核外共有5个电子层
B.该元素原子处于能量最低状态时,原子中共有3个未成对电子
C.该元素原子的M能层共有8个电子
D.该元素原子最外层共有3个电子
难度: 简单查看答案及解析
-
下列有关物质的性质或用途的说法中,全部正确的是
①氯气有漂白性,可直接使有色布条褪色;②二氧化硫有较强的还原性,不能用浓硫酸干燥;③
是酸性氧化物,能与氢氟酸反应;④硅酸钠水溶液可作为木材防腐剂。
A.①②③ B.②③④ C.①②④ D.③④
难度: 简单查看答案及解析
-
下列事实得出的判断合理的是 ( )
A.含有1mol HNO3的浓硝酸和稀硝酸分别与足量铜反应,稀硝酸溶液的铜更多,则稀硝酸的氧化能力强于浓硝酸
B.将某气体通入品红溶液中,品红溶液褪色,则该气体一定是SO2
C.HA的酸性比HB的强,则HA溶液的pH比HB溶液的小
D.铝箔在酒精灯火焰上加热熔化但不滴落,则氧化铝的熔点比铝的熔点高
难度: 简单查看答案及解析
-
迷迭香酸是从蜂花属植物中提取到的酸性物质,其结构
如下图所示。下列叙述正确的是 ( )
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗6molH2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.用石墨电极电解氯化铝溶液:Cl-+2H2O
Cl2↑+H2↑+2OH-
B.用氯气给自来水消毒:Cl2+H2O=2H++Cl-+ClO-
C.用Na2CO3溶液作洗涤剂:CO32- +H2O
HCO3-+OH-
D.氮化镁加入过量稀盐酸中:Mg3N2 + 6H+ === 3Mg2+ + 2NH3↑
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是 ( )
A.标准状况下,22.4L乙醇中含有的碳原子数目为2NApfue
B.1mol CnH2n含有的共用电子对数为(3n+1)NA
C.1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA
D.1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA
难度: 简单查看答案及解析
-
已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是
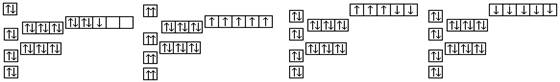
A. B. C. D
难度: 简单查看答案及解析
-
下表为短周期元素①~⑧的部分性质。
元素编号
元素性质
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/10-10m
0.66
1.36
1.23
1.10
0.99
1.54
0.70
1.18
最高化合价
+2
+1
+5
+7
+1
+5
+3
最低化合价
—2
—3
—1
—3
下列说法正确的是 ( )
A.元素①⑧形成的化合物具有两性
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素④⑤形成的化合物是离子化合物
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
难度: 简单查看答案及解析
-
常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
A (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
难度: 简单查看答案及解析