-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. v(W)=3v(Z) B. 2v(X)=3v(Z)
C. 2v(X)=v(Y) D. 3v(W)=2v(X)
难度: 简单查看答案及解析
-
l3C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A. 13C与15N有相同的中子数 B. 13C与12C性质相同
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是( )
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C. 电池反应的化学方程式为:CH3CH2OH+O2===CH3COOH+H2O
D. 正极上发生的反应为:O2+4e-+2H2O===4OH-
难度: 简单查看答案及解析
-
关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料。
A. ①②③④ B. ②③④ C. ③④ D. ②③
难度: 简单查看答案及解析
-
提出元素周期律并根据元素周期律编制第一个元素周期表的科学家是( )
A. 陈新生 B. 赵小红 C. 门捷列夫 D. 朱丽莎
难度: 简单查看答案及解析
-
以下化学用语正确的是
A. 石膏的化学式:
B. 明矾的化学式:
C. 氨分子的结构式:
D.
的电子式:
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 凡是放热反应的发生均无需加热
B. 凡是需要加热后才能发生的反应一定是吸热反应
C. 伴有能量变化的物质变化都是化学变化
D. 物质发生化学反应都伴随着能量变化
难度: 简单查看答案及解析
-
下列叙述中正确的是 ( )
A. 只有活泼金属与活泼非金属之间才能形成离子键
B. 具有共价键的化合物是共价化合物
C. 化学键是分子中多个原子之间强烈的相互作用
D. 具有离子键的化合物是离子化合物
难度: 简单查看答案及解析
-
下列有关电池的叙述正确的是 ( )
A. 锌锰干电池工作一段时间后碳棒变细
B. 氢氧燃料电池工作时氢气在负极被氧化
C. 太阳能电池的主要材料是高纯度的二氧化硅
D. 氢氧燃料电池可将热能直接转变为电能
难度: 简单查看答案及解析
-
下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
A
Mg 0.1mol
6mol· L—1硝酸10mL
60℃
B
Mg 0.1mol
3mol·L—1盐酸10mL
60℃
C
Fe 0.1mol
3mol·L—1盐酸10mL
60℃
D
Mg 0.1mol
3mol·L—1硫酸10mL
60℃
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molCl2中的化学键消耗的能量为Q2kJ,形成1molHCl中的化学键释放的能量为Q3kJ。下列关系式中正确的是( )
A. Q1+Q2>Q3 B. Q1+Q2>2Q3 C. Q1+Q2<Q3 D. Q1+Q2<2Q3
难度: 中等查看答案及解析
-
下列关于物质结构和化学用语的说法正确的是( )
A. BF3、CCl4中所有原子均达到8电子稳定结构
B. 18gH2O和D2O的中子数都为10NA个
C. 78 g Na2O2晶体中所含离子数目为3NA
D. 氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
难度: 简单查看答案及解析
-
根据相关的化学知识,下列判断正确的是( )
A. 由于水中存在氢键,所以稳定性:H2O>H2S
B. 由于氯化钠的相对分子质量比氟化钠的大,所以沸点:NaCl>NaF
C. 熔融态氯化铝与氯化铝水溶液均能导电
D. 由于磷和砷在元素周期表中位置相近,所以农药由含砷的有机物发展为对人畜毒性较低的含磷有机物
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3-> D-> B+> A2+ D. 单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
下列关于反应速率与化学反应限度的说法正确的是( )
A. 对于任意化学反应,其他条件不变时,增大压强都一定能加快化学反应速率
B. 化学平衡状态不一定是该反应在给定条件下的最大限度
C. 可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
D. 反应速率用于衡量化学反应进行的快慢,决定反应速率的主要因素是反应物的性质
难度: 简单查看答案及解析
-
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是

A. 黑磷导电属于化学变化
B. 黑磷属于化合物
C. 黑磷与白磷互为同素异形体
D. 黑磷高温下在空气中可以稳定存在
难度: 中等查看答案及解析
-
能说明氯的非金属性比硫强的事实是( )
A. 氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B. 向硫化氢的水溶液中通入氯气可得到淡黄色的硫
C. 氯气能与水反应而硫不能
D. 氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
难度: 简单查看答案及解析
-
2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A. Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B. Mc的最高价阳离子为Mc5+,氧化性比较弱
C. Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D. 根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
难度: 简单查看答案及解析
-
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )

A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与生成
难度: 中等查看答案及解析
-
下列各组物质含有的化学键类型完全相同的是( )
A. HBr、 CO2、 NH3 B. Na2O、 Na2O2、 Na2S
C. NaCl、 HCl、 H2O D. NaOH、 CaCl2、 CaO
难度: 简单查看答案及解析
-
对于100mL 0.5mol/LH2SO4溶液与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 1.0mol/LH2SO4溶液;③改用300mL 0.5mol/LH2SO4溶液;④用生铁代替铁片;⑤改用质量分数为98%的H2SO4溶液( )
A. ①③④ B. ①②④ C. ①②③④ D. ①②③⑤
难度: 简单查看答案及解析
-
A、B两种元素,A的原子序数为a,如果A和B同在第ⅣA族,当B的周期数大于A的周期数时,B的原子序数不可能为( )
A. a+2 B. a+8 C. a+26 D. a+18
难度: 简单查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
难度: 中等查看答案及解析
-
电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池。反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
A. 放电时负极反应为:Pb(s)+SO
(aq)-2e-===PbSO4(s)
B. 充电时电能转化为化学能
C. 放电时,电解液的密度增大
D. 充电时,电解液的pH减小
难度: 简单查看答案及解析
-
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
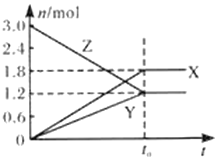
A. 该反应的化学方程式为:3Z
2X+3Y B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L D. t0时,反应停止,反应速率为0
难度: 中等查看答案及解析
-
X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
A.
×100% B.
×100% C.
×100% D.
×100%
难度: 简单查看答案及解析



