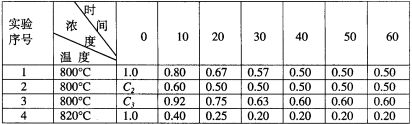
-
下列说法正确的是
A.食物在常温下腐败是自发进行 B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应 D.电解池的反应是属于自发反应
难度: 简单查看答案及解析
-
下列说法正确的是
A、热化学方程式的计量数可以表示分子的个数
B、热化学方程式中只需标明生成物的状态
C、反应热指的是反应过程中放出或吸收的热量
D、伴随能量变化的一定是化学变化
难度: 简单查看答案及解析
-
已知反应:
,
则反应
的△H为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.温度过高对合成氨不利
D.常温下,将 1 mL PH = 3的醋酸溶液加水稀释至100mL,测得其PH<5
难度: 中等查看答案及解析
-
下列关于铜电极的叙述正确的是
A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用铜作阳极 D.电解食盐水时铜作阳极
难度: 简单查看答案及解析
-
分别放在0.1mol·L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是

A.④>③>②>① B.③>①>②>④
C.④>③>①>② D.②>③>④>①
难度: 中等查看答案及解析
-
把铁放入盛有盐酸的试管中,不影响氢气产生速率的是
A.盐酸的浓度 B.用铁粉代替铁片
C.增大压强 D.溶液的温度
难度: 简单查看答案及解析
-
在一定条件下,反应A2(g) + B2(g)
2AB(g)达到平衡状态的是
A.单位时间内生成n mol的AB的同时,生成n mol的A2
B.单位时间内生成n mol A2的同时,生成n mol的B2
C.容器内的总压强不随时间而变化
D.单位时间内生成2n mol AB的同时,生成n mol的B2
难度: 简单查看答案及解析
-
已知反应A+3B
2C+D,在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5mol·L-1·min-1 B.1mol·L-1·min-1
C.2mol·L-1·min-1 D.3mol·L-1·min-1
难度: 简单查看答案及解析
-
下列变化过程中,∆S<0的是
A.蔗糖溶于水 B.氢气与氯气合成氯化氢
C.氨气与氯化氢合成氯化铵 D.加热KMnO4制O2
难度: 简单查看答案及解析
-
某温度下,反应SO2(g)+
O2(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO2(g) +
O2(g)的平衡常数K2的值为
A.2500 B.100 C.0.02 D.0.001
难度: 简单查看答案及解析
-
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用
A.NaOH B.HC1 C.NaCl D.CuSO4
难度: 简单查看答案及解析
-
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是
A.炭燃烧生成一氧化碳 B.酸碱中和反应
C.锌粒与稀H2SO4反应制取H2 D.Ba(OH)2·8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / L·s B.υ(C)=0.5 mol / L·s
C.υ(B)=0.6 mol / L·s D.υ(A)=0.15 mol / L·s
难度: 中等查看答案及解析
-
用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为
A.0.5mol·L- B.0.8mol·L-1
C.1.0mol·L-1 D.1.5mol·L-1
难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2由负极移向正极
B.通入丁烷的一极是正极,电极反应为:2C4H10+26e+13O2=4CO2+5H2O
C.通入空气的一极是负极,电极反应为:O2+4e=2O2
D.电池的总反应是:2C4H10+13O2 = 8CO2+10H2O
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 + Pb + 2H2SO4 = 2PbSO4↓ + 2H2O,根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb + SO
– 2e – = PbSO4↓
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
难度: 中等查看答案及解析
-
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2
2 NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是
A.431 KJ/mol B.946KJ/mol
C.649 KJ/mol D.869 KJ/mol
难度: 中等查看答案及解析
-
已知:C(s)+CO2(g)
2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
难度: 中等查看答案及解析