-
下列物质属于酸性氧化物但不溶于水的是
A.CO2 B.SiO2 C.SO3 D.Fe2O3
难度: 中等查看答案及解析
-
下列物质中,有极性共价键的是 ( )
A.单质碘 B.氯化镁 C.溴化钾 D. 水
难度: 简单查看答案及解析
-
与3.2 g SO2 所含的氧原子数相等的NO2的质量为
A.2.3 g B.3.2 g C.4.6 g D.6.4 g
难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
难度: 中等查看答案及解析
-
下列酸在与金属发生反应时,其中S或N元素的化合价不会发生变化的是
A.稀硫酸 B.稀硝酸 C.浓硫酸 D.浓硝酸
难度: 简单查看答案及解析
-
下列各组物质的性质比较中不正确的是( )
A. 氧化性:F2>C12>Br2 B. 酸性:HClO4>H2SO4>H3PO4
C. 碱性:NaOH>Mg(OH)2>Al(OH)3 D. 热稳定性:SiH4>PH3>H2S
难度: 简单查看答案及解析
-
下列方程式中,错误的是( )
A.将氨通入盐酸中:NH3+H+===NH4+
B.在NaOH溶液中滴入NH4Cl溶液:NH4++OH-===NH3.H2O
C.将少量铜屑放入浓硝酸中:Cu+4H++2NO3-===Cu2++2NO2 ↑ +2H2O
D.将稀硫酸滴在铜片上:Cu+2H+===Cu2++H2 ↑
难度: 困难查看答案及解析
-
锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge与碳同主族)元素处于最高价态,铋元素(Bi与氮同主族)的价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。BGO的化学式是( )
A. Bi3Ge3O15 B. Bi4Ge3O12 C. Bi4Ge3O16 D. Bi3Ge3O12
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:

下列叙述正确的是( )
A. L、R的单质与稀盐酸反应速率L< R B. M与T形成的化合物有两性
C. Q、T两元素的氢化物分子间都存在氢键 D. L、Q形成的简单离子核外电子数相等
难度: 中等查看答案及解析
-
下列关于铷(Rb)的叙述正确的是( )
A. 它位于周期表的第四周期、第ⅠA族
B. 氢氧化铷是弱碱
C. 在钠、钾、铷3种单质中,铷的熔点最高
D. 硝酸铷是离子化合物
难度: 中等查看答案及解析
-
标准状况下的28LNH3溶于125mL水中,若所得氨水的密度近似为1g•cm-3,则下列说法正确的是( )
A. 此氨水中NH3的物质的量浓度近似为0.224mol•L-1
B. 此氨水中NH3的物质的量浓度近似为10mol•L-1
C. 此氨水中NH3的物质的量浓度近似为8.55mol•L-1
D. 此氨水中NH3的质量分数为0.17
难度: 中等查看答案及解析
-
下列关于物质性质变化的比较中,不正确的是
A. 碱性强弱:KOH>NaOH>LiOH B. 原子半径大小:Na>S>O
C. 酸性强弱:HIO4>HBrO4>HClO4 D. 金属性强弱:Na>Mg>Al
难度: 中等查看答案及解析
-
某原电池总反应离子方程式为2Fe3++Fe═3Fe2+,能实现该反应的原电池是
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铜,负极为铁,电解质溶液为Fe(NO3)2溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D.正极为银,负极为铁,电解质溶液为CuSO4
难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.化学反应必然伴随发生能量变化
B.化学变化中的能量变化主要是由化学键变化引起的
C.化学反应中能量变化的大小与反应物的质量多少无关
D.能量变化是化学反应的
基本特征之一
难度: 中等查看答案及解析
-
用下列实验装置进行的实验,能达到相应实验目的是( )
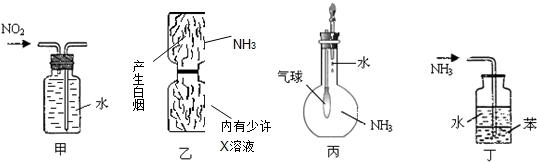
A.装置甲:收集NO2气体
B.装置乙:验证X溶液为浓硫酸
C.装置丙:验证氨气在水中的溶解性
D.装置丁:用于吸收尾气NH3
难度: 中等查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需能量(KJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(KJ)是
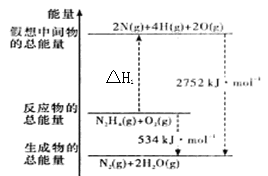
A.194 B.391 C.516 D.658
难度: 困难查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0L B.13.5L C.15.7L D.16.8L
难度: 困难查看答案及解析