-
根据所给的信息和标志,判断下列说法正确的是
A
B
C
D
《本草纲目拾遗》中述“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,.....,所刮下之销末,名铁线粉”
《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”
可燃冰


“铁线粉”是Fe3O4
利用KNO3的氧化性
“可燃冰”是可以燃烧的水
“绿色食品”是指绿色的食品
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2
CCl4
正十二烷
密度/g·cm-3
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
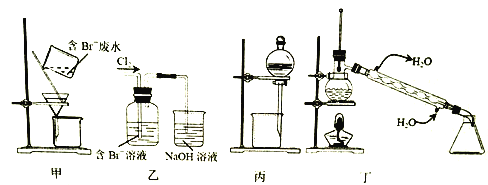
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 随着碳原子数目的增多,烷烃的含碳量逐渐减小
B. 有机物都能在氧气中充分燃烧,产物之一是二氧化碳
C. 苯乙烯(
)与乙苯的一氯代物数目不同
D. 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
难度: 中等查看答案及解析
-
2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
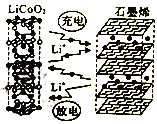
A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
难度: 中等查看答案及解析
-
下列实验、现象、结论均正确的是
实验
现象
实验结论或解释
A
将浓硫酸加入到滴有几滴水的蔗糖中
蔗糖逐渐变黑形成“黑面包”,并伴有刺激性气体产生
体现了浓硫酸的脱水性和强氧化性
B
向饱和Na2CO3溶液中滴加少量稀盐酸
立即有气体逸出
CO32-+2H+=H2O+CO2↑
C
将铜片放入浓硝酸中
没有明显变化
铜在常温下遇浓硝酸钝化
D
铝箔在酒精灯火焰上加热
剧烈燃烧并有白色粉末滴落
滴落的白色粉末为Al2O3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W 处于同一主族,Y、Z的原子最外层电子数之和等于9,X的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. 简单离子半径: Y<Z<W
B. W的氧化物对应的水化物的酸性一定比X的强
C. Y的简单气态氢化物的热稳定性一定比W的强
D. Y分别与X、Z形成的化合物,其所含化学键的类型相同
难度: 中等查看答案及解析
-
某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.mol/L的Na2CO3溶液,滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是
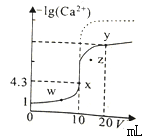
A. Ksp(CaCO3)=5×10-10
B. Z点对应的分散系很稳定
C. W、x、y三点中,水的电离程度最大的为y点
D. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
难度: 中等查看答案及解析



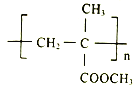 。以下是有机玻璃的一种合成路线:
。以下是有机玻璃的一种合成路线: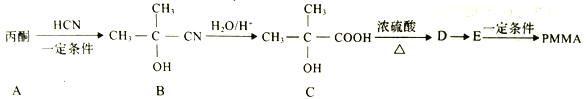
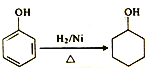 ____________
____________