-
化学已经渗透到人类生活的各个方面,下列说法不正确的是。
A. 明矾能水解生成氢氧化铝胶体,可用作净水剂
B. 垃圾是放错地方的资源,应分类回收利用
C. 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D. 高纯度的硅单质广泛用于制作光导纤维
难度: 中等查看答案及解析
-
进行化学实验必须注意安全,下列操作不正确的是
A. 做CO还原CuO的实验时,尾气用点燃的方法除去
B. 实验室制备并用排水法收集氧气,实验结束时应先撤导管再熄灭酒精灯
C. 金属钠、钾起火,可用水、泡沫灭火器等灭火
D. 给试管中的液体加热时先预热并不时移动试管或加入碎瓷片,以免爆沸伤人
难度: 中等查看答案及解析
-
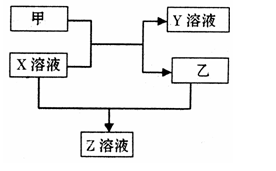
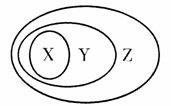
下列各组物质或概念之间,不符合下图所示关系的是

难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+
C. 加入Al能放出H2的溶液中:Cl-、HCO3-、SO4+、NH4+
D. 在酸性溶液中:Ba2+、Na+、SO42-、Cl
难度: 中等查看答案及解析
-
下列与实验相关的叙述正确的是
A. 红热的铜丝在氯气中燃烧,产生棕黄色的烟雾
B. 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C. 除去NaHCO3溶液中混有的少量Na2CO3,可采取通入二氧化碳气体的方法
D. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
难度: 中等查看答案及解析
-
下列说法正确的是
A. 胶体粒子的直径很小可以透过滤纸,因此可以用过滤的方法分离胶体和溶液
B. 布朗运动不是胶体特有的性质
C. 直径介于l-100nm之间的微粒称为胶体
D. 有的胶体带正电荷或者负电荷,在电压作用下可电泳
难度: 中等查看答案及解析
-
下列实验过程中,无明显现象的是
A. NO2通入FeSO4溶液中
B. 胆矾中加入浓硫酸
C. CO2通入CaCl2溶液中
D. SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
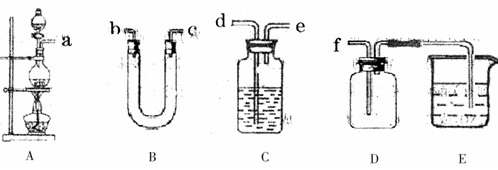
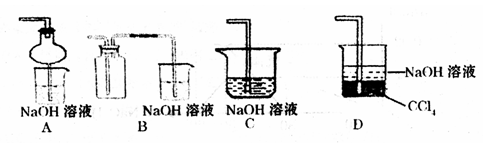
下列能达到实验目的的是
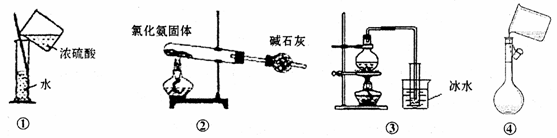
A. 用装置①稀释浓硫酸 B. 用装置②制备氨气
C. 用装置③从海水中制备少量蒸馏水 D. 用装置④向容量瓶中转移溶液
难度: 中等查看答案及解析
-
下列是某学生总结的一些规律,其中正确的是
A. 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物
B. 酸性氧化物都可以与碱反应,生成盐和水
C. 酸根离子中不可能含有金属元素
D. 氧化物只能做氧化剂,不能做还原剂
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
B. 用过氧化钠与水反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
C. 用氨水检验氯化镁溶液中混有氯化铝杂质:
Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
难度: 中等查看答案及解析
-
下列实验设计能完成预期实验目的的是
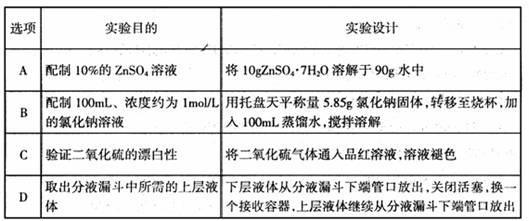
难度: 中等查看答案及解析
-
图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法不正确的是

A. 该硫酸的物质的量浓度为18.4 mol·L-1
B. 配制500mL 3.68 mol·L-1的稀硫酸,需取该硫酸100.0 mL
C. 该硫酸与等体积的水混合,所得溶液的质量分数大于49%
D. 该硫酸50mL与足量的铜充分反应,可得到标准状况下SO2 20.6 L
难度: 中等查看答案及解析
-
在H2O2溶液中加入KI和H2SO4的混合溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;②H2O2+I2=2HIO;③H2O2+2HIO=I2+O2↑+2H2O。下列说法正确的是
A. H2O2在上述3个反应中均做氧化剂
B. H2O2氧化性强于HIO,还原性弱于I2
C. 上述过程中每生成1mol氧气,消耗1mol双氧水
D. 在反应后的溶液中加入淀粉,溶液呈现蓝色
难度: 中等查看答案及解析
-
已知NA代表阿伏加德罗常数,下列说法正确的是
A. 224mL氧气和氮气的混合气体的分子数为0.01NA
B. 0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA
C. 在0.2L0.5mol/LAlCl3溶液中Al3+数目是Cl-数目的1/3
D. 5.6g铁粉在2.24L(标准状态)氯气中充分燃烧,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
X、Y、Z、W有如下图所示的转化关系,则X、Y可能是( )
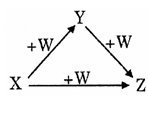
①C、CO ②AlCl3、Al(OH)3
③Fe、FeCl3 ④Na2CO3、NaHCO3
A. 只有①② B. 只有③④
C. 只有①②④ D. ①②③④
难度: 中等查看答案及解析
-
氧化铁和氧化铜混合物mg,加3mol·L-1盐酸溶液100mL,恰好完全溶解,若mg的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为( )
A.(m-2.4)g B.(m-1.6) g C.(m-3.2)g D. 无法确定
难度: 中等查看答案及解析