-
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 玻璃棒 B. 胶头滴管 C. 试管 D. 漏斗
难度: 简单查看答案及解析
-
选择一种容积将溴水中的溴萃取出来,这种溶剂应该具有的性质
A.易溶于水,且不与溴发生反应 B.不溶于水,且密度必须比水小
C.不溶于水,且密度必须比水大 D.不溶于水,且比水更容易使溴溶解
难度: 中等查看答案及解析
-
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④ 压强 ⑤刻度线 ⑥酸式或碱式这六项中的
A. ②④⑥ B. ③⑤⑥ C. ①③⑤ D. ①②④
难度: 简单查看答案及解析
-
为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。
①过滤 ②加过量的NaOH ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
其中正确的操作顺序是
A.②⑤④①③ B.④①②⑤③
C.①④②⑤③ D.⑤②①④③
难度: 中等查看答案及解析
-
30ml 5mol/LNaOH溶液中NaOH的质量为
A.4g B.5g C.6g D.7g
难度: 简单查看答案及解析
-
关于分液漏斗的使用,下列说法正确的是
A.可在分液漏斗内用四氯化碳萃取碘酒中的碘单质
B.放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁
C.在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触
D.分液漏斗在使用前只需检查旋塞芯处是否漏水即可
难度: 中等查看答案及解析
-
若m g氧气含n个氧气分子,则阿伏伽德罗常数为
A.2n B.16n/m C.n D.32n/m
难度: 简单查看答案及解析
-
下列实验操作中错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸发结晶时应将溶液蒸干
C. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
D. 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
难度: 中等查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.蒸馏、萃取、分液 D.分液、蒸馏、萃取
难度: 中等查看答案及解析
-
实验中的下列操作正确的是
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为不浪费,又把过量的试剂倒入试剂瓶中
B. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
难度: 困难查看答案及解析
-
下列说法正确的是
A.标准状况下,22.4L水的物质的量为1摩尔
B.常温常压下,32g O3气体物质的量为1摩尔
C.标准状况下,a L的氧气和氮气的混合物含有的分子数约为a/22.4×6.02×1023
D.2.24L CO2中含有的原子数为0.3×6.02×1023
难度: 中等查看答案及解析
-
下列各组物质中,所含分子数相同的是
A.1gH2和1gO2 B.5.6LN2(标准状况)和22gCO2
C.9gH2O和0.5molCl2 D.22.4LH2(标准状况)和0.1molN2
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.1molO2的质量是32g·mol-1
B.SO 4 2 - 的摩尔质量为 96 g·mol-1
C.1摩尔任何物质的质量等于该物质的相对分子质量
D.CO2的摩尔质量是44g
难度: 简单查看答案及解析
-
实验室盛放氢氧化钠的试剂瓶应贴有的安全使用标识是
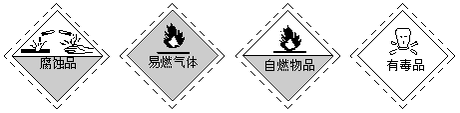
难度: 简单查看答案及解析
-
下列实验正确的是
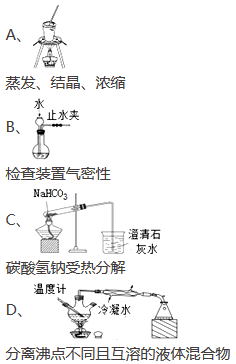
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是
A.BaCl2、Na2CO3、盐酸、AgNO3
B.Na2CO3、盐酸、AgNO3、BaCl2
C.BaCl2、Na2CO3、AgNO3、盐酸
D.AgNO3、盐酸、BaCl2、Na2CO3
难度: 极难查看答案及解析
-
实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3 ,实验员选择了一种试剂就把它们区别开来了,这种试剂是:
A.氯化钡溶液 B.氢氧化钠溶液 C.盐酸 D.硝酸
难度: 中等查看答案及解析
-
和22gCO2所含分子数相等的水的质量为
A.44g B.9g C.18g D.22g
难度: 简单查看答案及解析
-
水是人类赖以生存的物质,H2O的摩尔质量为
A.16g/mol B.18g C.20g/mol D.18g/mol
难度: 简单查看答案及解析
-
在标准状况下,2.7g的某气体体积为672ml,则该气体的摩尔质量为
A.65g·mol-1 B.70g·mol-1 C.80g·mol-1 D.90g·mol-1
难度: 中等查看答案及解析
-
欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的固体混合物分离,最科学的操作顺序是
A.溶解、过滤、加热(升华)、蒸发(结晶)
B加热(升华)、 溶解、过滤、蒸发(结晶)
C.升华、溶解、蒸馏、结晶
D.溶解、结晶、过滤、升华
难度: 中等查看答案及解析