-
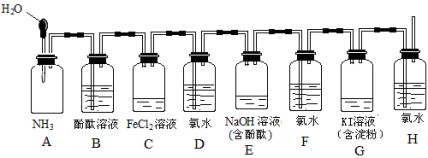
下列污染现象主要与含硫化合物有关的是
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
难度: 简单查看答案及解析
-
下列物质分类正确的是
A.H2SO4、NaOH、NaNO3都是电解质
B.Na2O、Na2O2、Fe2O3都是碱性氧化物
C.氢氧化铁胶体、硝酸、小苏打都是混合物
D.烧碱、纯碱、熟石灰都是碱
难度: 中等查看答案及解析
-
某课外实验小组设计的下列实验不合理的是
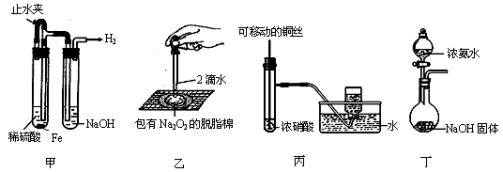
A.甲可用于制备并观察氢氧化亚铁沉淀
B.乙可用于证明过氧化钠与水反应放热
C.丙可用于制备并收集少量NO2气体
D.丁可用于实验室制备少量氨
难度: 中等查看答案及解析
-
利用100mL0.50 mol·L-1 Na2CO3溶液配制Na+浓度为0.20 mol·L-1的溶液,下列操作正确的是
A.将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
B.将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌
C.将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌
D.将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述错误的是
A.标准状况下,1molSO3(s)的体积约为22.4L
B.100mL0.10 mol·L-1AlCl3溶液中,Cl-的数目为0.03NA
C.18g水中,电子的数目为10NA
D.3molCu与稀硝酸完全反应,被还原的NO3-数目为2NA
难度: 中等查看答案及解析
-
下列离子在溶液中可以大量共存的是
A.Na+ Ca2+ OH- CO32- B.Al3+ H+ Cl- SO42-
C.Fe2+ H+ NO3- SO42- D.Na+ H+ SO32- ClO-
难度: 中等查看答案及解析
-
下列实验方案能达到目的的是
A.除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B.用加热法除去Na2CO3固体中的NaHCO3
C.用点燃法除去CO2中的CO
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
难度: 中等查看答案及解析
-
下列药品久置空气中,溶液中溶质的种类和数量几乎没有变化的是
A.NaOH溶液 B.H2SO3溶液 C.浓硝酸 D.浓硫酸
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.氨水与稀盐酸反应:H+ + OH- = H2O
B.FeCl3溶液与铁反应:Fe3+ + Fe = 2Fe2+
C.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.KOH稀溶液中通入过量的SO2:SO2+OH-=HSO3-
难度: 中等查看答案及解析
-
下列物质加入或通入紫色石蕊溶液中,能发生先变红后褪色现象的是
A.Na2O2 B.稀硝酸 C.SO2 D.Cl2
难度: 中等查看答案及解析
-
下列由相关实验现象所推出的结论正确的是
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
常温下,在避光的容器中,将下列各组气体充分混合后能发生明显反应的是
A.H2和Cl2 B.SO2和H2S C.H2和O2 D.N2和H2
难度: 中等查看答案及解析
-
下列关于物质的检验说法不正确的是
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,原溶液含有SO42-
B.加入盐酸,生成刺激性气味的气体,并能使品红溶液褪色,则原溶液中可能有SO32-
C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+
D.加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则原溶液中含有CO32-
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
难度: 中等查看答案及解析
-
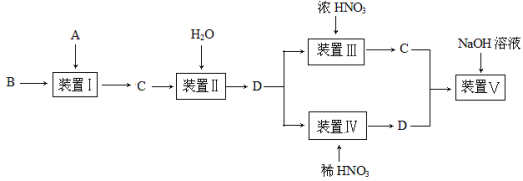
可用右图所示装置制取、净化、收集的气体是
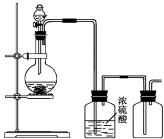
A.亚硫酸钠固体与硫酸反应制二氧化硫
B.浓氨水与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.铜与稀硝酸反应制一氧化氮
难度: 中等查看答案及解析
-
中科大陈乾旺教授等人发明人工合成金刚石的新方法,其化学原理为:
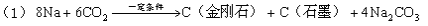
该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
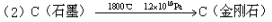
以下有关表述中正确的是
A.新法(1)利用的是化学变化,旧法(2)利用的是物理变化
B.在反应(1)中,利用了金属钠的还原性
C.在反应(1)中每生成12g金刚石需要消耗23g金属钠
D.在反应(1)和(2)中,金刚石都是还原产物
难度: 中等查看答案及解析