-
全球变暖给我们敲响了警钟,地球正面临巨大的挑战。下列说法不正确的是( )
A.推广“低碳经济”,减少温室气体的排放
B.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展
C.推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油
D.利用晶体硅制作的太阳能电池将太阳能直接转化为电能
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同条件下进行合成氨的反应。根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(H2)=0.1 mol·L-1·min-1
B.v(N2)=0.1 mol·L-1·min-1
C.v(N2)=0.2 mol·L-1·min-1
D.v(NH3)=0.3 mol·L-1·min-1
难度: 中等查看答案及解析
-
反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加铁的量
B.将容器体积缩小一半
C.升高温度
D.压强不变,充入N2使容器体积增大
难度: 中等查看答案及解析
-
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜, s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
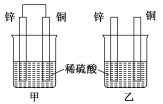
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) ΔH<0,下列各图正确的是
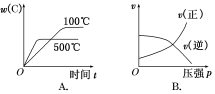

难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=10-7 mol·L-1的溶液
C.c(H+)/c(OH-)=10-14的溶液
D.氨水和硫酸铵的混合液中c(NH4+)=2c(SO42-)
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则H2的燃烧热为241.8 kJ/mol
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2;则ΔH1<ΔH2
难度: 中等查看答案及解析
-
已知:HCN( aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1; HCl(aq)与NaOH(aq)反应的ΔH=-55. 6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
难度: 中等查看答案及解析
-
有关键能(破坏1 mol共价键吸收的能量)数据如表
化学键
Si—O
O===O
Si—Si
键能/kJ·mol-1
X
498.8
176
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)
A.423.3 B.460 C.832 D.920
难度: 简单查看答案及解析
-
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法错误的
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
以硫酸铜作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是
①粗铜与直流电源负极相连;
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
A.①③ B.②④ C.③④ D.②③
难度: 中等查看答案及解析
-
用惰性电极电解足量的下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是
A.CuCl2[CuSO4] B.NaOH[H2O]
C.NaCl[H2O] D.CuSO4[Cu(OH)2]
难度: 中等查看答案及解析
-
常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
A.四种溶液的KW相同,由水电离的c(H+):①=③>②=④
B.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①
C.①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>②
难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:
CO(g)+H2O(g)
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
A.25% B.50% C.75% D.80%
难度: 中等查看答案及解析
-
充分燃烧一定量的丁烷气体放出的热量为Q,完全吸收它生成的CO2气体生成正盐,需5 mol·L-1的NaOH溶液100 mL,则丁烷的燃烧热为
A.16Q B.8Q C.4Q D.2Q
难度: 中等查看答案及解析
-
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是
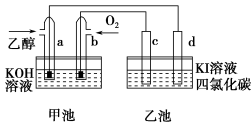
A.两个装置之间没有盐桥,故不能形成电流
B.a电极的电极反应式C2H5OH+16OH--12e-===2CO32-+11H2O
C.一段时间后,乙池d电极周围的溶液呈现棕褐色
D.乙池在反应前后溶液的pH不变
难度: 中等查看答案及解析
-
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是
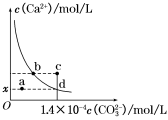
A.x数值为2×10-5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
难度: 中等查看答案及解析
-
下列各组离子在指定条件下,一定能大量共存的是
A.使石蕊试液变红色的溶液中:K+、Na+、CO32-、NO3-
B.在酸性高锰酸钾溶液中:Na+、NH4+、I-、Br-
C.c(H+)=10-1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
D.水电离出的c(H+)=10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
难度: 中等查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是
A.放电时负极反应为:Zn - 2e— + 2OH— == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e— + 5OH— == FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
难度: 中等查看答案及解析
-
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是
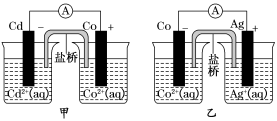
A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq)
B.2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)反应能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出
难度: 中等查看答案及解析