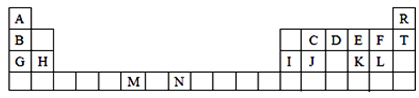
-
下列电子层中,原子轨道的数目为4的是 ( )
A. K层 B. L层 C. M层 D. N层
难度: 简单查看答案及解析
-
氢原子的电子云图中的小黑点表示的意义是( )
A. 一个小黑点表示一个电子 B. 黑点的多少表示电子个数的多少
C. 表示电子运动的轨迹 D. 电子在核外空间出现机会的多少
难度: 简单查看答案及解析
-
以下能级符号不正确的是( )
A. 3s B. 3p C. 3d D. 3f
难度: 中等查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是: ( )
A. Fe B. Mg C. P D. La
难度: 简单查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2表示,单位为kJ/mol)。
I1
I2
I3
I4
……
R
740
1 500
7 700
10 500
……
下列关于元素R的判断中一定正确的是( )
A. R元素位于元素周期表中第ⅡA族
B. R的最高正价为+3价
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
难度: 简单查看答案及解析
-
下列分子中属于非极性分子的是( )
A .HF B .H2O2 C .CO2 D.NH3
难度: 简单查看答案及解析
-
下列关于价电子构型为3s23p4的粒子描述正确的是
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布轨道式为:
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H4
难度: 中等查看答案及解析
-
下列分子中键角最大的是( )
A. CH4 B. H2O
C. CO2 D. NH3
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数) ( )
A. 电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA
D. SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键
难度: 中等查看答案及解析
-
萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
难度: 简单查看答案及解析
-
下列说法正确的是
A. 电离能大的元素,不易失电子,易得到电子,表现非金属性
B. 电离能大的元素其电负性必然也大
C. 电负性最大的非金属元素形成的含氧酸的酸性最强
D. 电离能最小的元素形成的氧化物的水化物的碱性最强
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.互为手性异构体的分子互为镜像 B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同 D.手性异构体性质相同
难度: 中等查看答案及解析
-
下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
A.SiO2和干冰的熔化 B.氧化钠和钠的熔化
C.晶体硅和晶体硫的熔化 D.碘和干冰的气化
难度: 中等查看答案及解析
-
下列温室气体中,和 CO2一样,既是非极性分子,所有的原子又都达到8电子稳定结构的是( )
A. N2O B. CF2=CF2 C. CCl2F2 D. SF6
难度: 中等查看答案及解析
-
下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子在高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是 ( )
A. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
B. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
C. 向反应后的溶液加入乙醇,溶液没有发生变化
D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 分子晶体中都存在共价键
B. F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C. 氯元素含氧酸酸性 HClO > HClO2
D. 只要是离子化合物,其熔点一定比共价化合物的熔点高
难度: 中等查看答案及解析
-
下列数据是对应物质的熔点
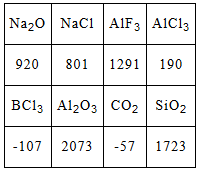
据此做出的下列判断中错误的是( )
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
难度: 简单查看答案及解析
-
下列关于晶体的说法一定正确的是( )
A. 在晶体中只要有阳离子就一定有阴离子
B. CaTiO3晶体(如图)中每个Ti4+和12个O2-相紧邻

CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
C. 金属晶体中金属离子电荷数越多,离子半径越小,金属键就越弱
D. 金属晶体的熔点都比分子晶体的熔点高
难度: 中等查看答案及解析
-
有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
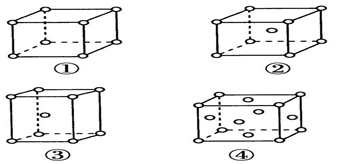
A. ①为简单立方堆积,②为六方最密堆积,③为体心立方,④为面心立方最密堆积
B. 空间利用率的大小关系为①<②<③<④
C. 晶胞中原子的配位数分别为①6,②8,③8,④12
D. 每个晶胞含有的原子数分别为①1,②2,③2,④4
难度: 中等查看答案及解析