-
下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,
反应为吸热反应
C.为了提高煤的利用率,常将煤气化或直接液化后燃烧。煤气化或直接液化属于物理变化
D.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H
=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是()
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
难度: 简单查看答案及解析
-
已知下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol
且Q1>Q2,则不正确的是( )
A.燃烧白磷放出的能量比燃烧红磷放出的能量多
B.白磷转化为红磷是属于放热反应
C.白磷和红磷互为同素异形体
D.等质量的白磷和红磷,白磷含有的能量比红磷的低
难度: 简单查看答案及解析
-
在密闭容器中有可逆反应nA (g)+mB(g)
pC(g) △H>0 处于平衡状态(知n+m>p),下列说法正确的是( )
①升高温度时,c(B)/c(C)的比值减小 ②降温时,体系内混合气体平均式量减小
③加入B,A的转化率变大 ④加入催化剂,气体的总物质的量不变
⑤充入C,则A,B的物质的量增大
A ③④ B ①②⑤ C ②③⑤ D 全部
难度: 简单查看答案及解析
-
在一密闭容器中进行下列反应:2SO2+O2
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是 ( )
A.SO2为0.4mol/L,O2为0.2mol/L B.SO2为0.25mol/L
C.SO2,SO3均为0.15mol/L D.SO3为0.4mol/L
难度: 简单查看答案及解析
-
下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率
难度: 简单查看答案及解析
-
某温度下,已知反应mX(g)+ nY(g)
qZ(g) △H= +Q kJ·mol—1(Q>0),下列叙述正确的是( )
A.反应达到最大限度时,加入X,反应的△H增大
B.在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量
C.反应速率υ正(X) =
υ正(Y) D.降低温度,反应的速率值变大
难度: 简单查看答案及解析
-
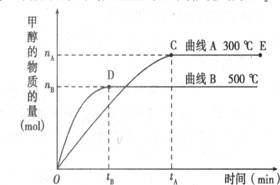
已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。
 下列说法不正确的是 ( )
下列说法不正确的是 ( )A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线
B.前10 min内用v(N2O4)表示的化学反应速率为0.02 mol/(L·min)
C.25 min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L
D.前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L·min)
难度: 简单查看答案及解析
-
一个真空密闭容器中盛有1molPCl5,加热到200℃时发生了反应:PCl5(g)
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M %,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N %。M与N的关系是 ( )
A.M>N B.M<N C.M=N D.无法确定
难度: 简单查看答案及解析
-
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)
xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ).
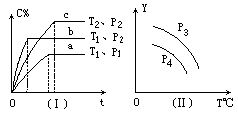
A.p3>p4,Y轴表示A的质量 B.p3<p4,Y轴表示B的百分含量
C.p3>p4,Y轴表示混合气体密度 D. p3>p4,Y轴表示混合气体平均摩尔质量
难度: 简单查看答案及解析