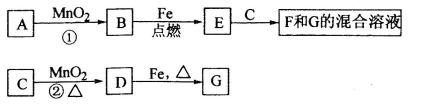
-
下列物质见光不会分解的是( )
A.HClO B.NH4Cl C.HNO3 D.AgNO3
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是 ( )
A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
难度: 中等查看答案及解析
-
甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-、I-)离子,向甲溶液中加入淀粉溶液和氯水,则溶液变为橙色,再加入丙溶液,颜色无明显变化.则甲、乙、丙中依次含有的卤素离子是( )
A.Br-、Cl- 、I- B.Br- 、I-、Cl- C.I- 、Br -、Cl- D.Cl-、I-、Br-
难度: 困难查看答案及解析
-
下列有关化学反应过程或实验现象的叙述中,正确的是( )
A. 氯气的水溶液可以导电,说明氯气是电解质
B. 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C. 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D. 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液具有酸性
难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是( )
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将Cl2与HCl混合气体通过饱和食盐水可得到干燥纯净的Cl2
难度: 中等查看答案及解析
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
放在敞口
容器中的下列溶液,久置后溶液中该溶质的浓度会变大的是 ( )
A.浓硫酸 B.氢氧化钠 C.氯水 D.氯化钠
难度: 简单查看答案及解析
-
下列关于氯的说法正确的是
A.Cl2在化学反应中既能作氧化剂,又能作还原剂
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
C.Cl2通入到含有酚酞的NaOH溶液中,红色褪去,因为氯气有漂白性
D.将SO2通入次氯酸钙溶液可生成次氯酸
难度: 中等查看答案及解析
-
将0.2molMnO2和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为( )(不考虑盐酸的挥发)
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
难度: 中等查看答案及解析
-
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
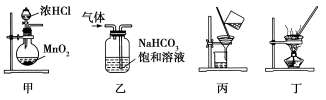
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
难度: 中等查看答案及解析
-
标准状况下H2和Cl2组成的混合气体2.24L,经点燃充分反应后,缓缓通入100mL 1.2mol/LNaOH溶液中恰好完全反应,测得最终溶液中NaClO的浓度为0.2mol/L(假设溶液体积不变),则原混合气体中Cl2的体积分数(物质的量百分含量)为
A.55% B.60% C.65% D.70%
难度: 中等查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液
难度: 简单查看答案及解析
-
某铁的氧化物(F
exO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mLCl2,恰好将Fe2+完全氧化。x值为( )
A.0.80 B.0.85 C.0.90 D.0.93
难度: 中等查看答案及解析
-
某同学用下列装置制备并检验Cl2的性质。

下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
难度: 极难查看答案及解析