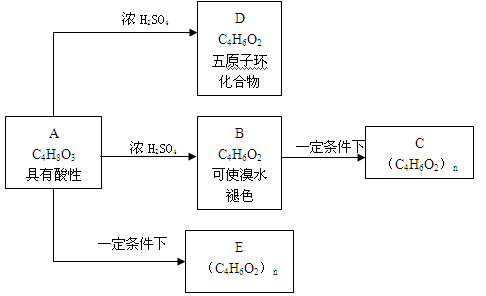
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
A.NaOH(固体) B.H2O
C.NH4Cl(固体) D.CH3COOH
难度: 中等查看答案及解析
-
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
难度: 中等查看答案及解析
-
在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钡溶液
难度: 中等查看答案及解析
-
在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为A与B摩/升,则A和B关系为
A.A>B B.A=10-4B C.B=10-4A D.A=B
难度: 中等查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl-
B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2-
D.K+ NH4+ SO42- NO3-
难度: 中等查看答案及解析
-
pH=2的X、Y、Z三种酸的水溶液各1 mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,则下列说法正确的是

A.原溶液的浓度大小c(X)>c(Z)>c(Y)
B.Z是强酸,Y和X是弱酸
C.相同浓度的钠盐溶液,其pH由小到大的顺序:NaZ>NaY>NaX
D.1mol•L-1NaY溶液中离子浓度:C(Na﹢)>C(Y-)>C(H﹢)>C(OH-)
难度: 困难查看答案及解析
-
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A.等于p% B.大于p% C.小于p% D.无法判断
难度: 中等查看答案及解析
-
在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应2R(气)+5Q(气)
4X(气)+nY(气)反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中
A.[HCOO-]>[Na+] B.[HCOO-]<[Na+]
C.[HCOO-]=[Na+] D.无法确定[HCOO-]与[Na+]的关系
难度: 中等查看答案及解析
-
下列有关pH变化的判断中,正确的是
A.随温度的升高,碳酸钠溶液的pH减小
B.随温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH增大
难度: 中等查看答案及解析
-
用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A.
B.
C.[H﹢]和[OH-]的乘积 D.OH-的物质的量
难度: 中等查看答案及解析
-
可逆反应:3A(气)
3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C一定都是固体
难度: 困难查看答案及解析
-
在一密闭容器中,反应aA(气)
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减少了 D.a>b
难度: 中等查看答案及解析
-
把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5mol/L盐酸
C.0.5mol/L HAc溶液 D.0.5mol/LKCl溶液
难度: 中等查看答案及解析
-
常温下,向10mL pH=10的KOH溶液中加入pH=4的一元酸HA的溶液至pH刚好等于7(假设反应体积不变),则对反应后溶液的叙述错误的是
A.c(A-)=c(K+)
B.c(K+)+c(H+)=c(OH-)+c(A-)
C.c(H+)=c(OH-)<c(K+)<c(A-)
D.V总≤20mL
难度: 中等查看答案及解析
-
下图是温度和压强对X+Y
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是

A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1
C(s)+
O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3
S(g)+O2(g)===SO2(g);△H4
③H2(g)+
O2(g)===H2O(l);△H5
2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7
CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
难度: 中等查看答案及解析
-
强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1);ΔH=﹣57.3KJ•mol-1
已知:(aq)+NaOH(aq)= CH3COONa(aq)+H2O(1);ΔH1
1/2H2SO4(浓)+ NaOH(aq)= 1/2Na2SO4(aq)+H2O(1);ΔH2
HNO3(aq)+ KOH(aq)=KNO3(aq)+H2O(1);ΔH3
上述反应均为在溶液中的反应,则ΔH1、ΔH2、ΔH3的关系正确的是
A.ΔH1=ΔH2=ΔH3 B.ΔH2<ΔH1<ΔH3
C.ΔH2<ΔH3<ΔH1 D.ΔH2=ΔH3<ΔH1
难度: 中等查看答案及解析
-
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P—P:198;P—O:360;O—O:498。则反应P4(白磷)+3O2=P4O6的反应热△H为
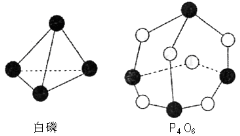
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
难度: 困难查看答案及解析